Exercice n°4
1-
Le butan-2-ol est
oxydé par le permanganate de potassium en milieu acide.
a-
Nommer le produit qui résulte de l’oxydation de cet alcool.
b-
Ecrire le bilan équilibré de la réaction globale
2- Le butan-1-ol est traité par le chlorure d’éthanoyle
a-
Ecrire l’équation bilan de la réaction
b-
Qu’obtiendrait-on en remplaçant le chlorure d’éthanoyle
par l’acide acétique ? Ecrire l’équation bilan.
c- Quel est l’intérêt de remplacer l’acide
acétique par le chlorure d’éthanoyle.
Corrigé
1.
a- On obtient de la butan-2-one.
b- On écrit d’abord les demi-équations électroniques :
MnO4- + 8 H+ + 5é = Mn2+ + 4 H2O x2
CH3CHOHCH2CH3 = CH3C=OCH2CH3
+ 2 H+ + 2é x5
5 CH3CHOHCH2CH3 + 2 MnO4- + 6 H+ = 2 Mn2+ + 8 H2O + 5 CH3C=OCH2CH3
2.
a- On obtient :
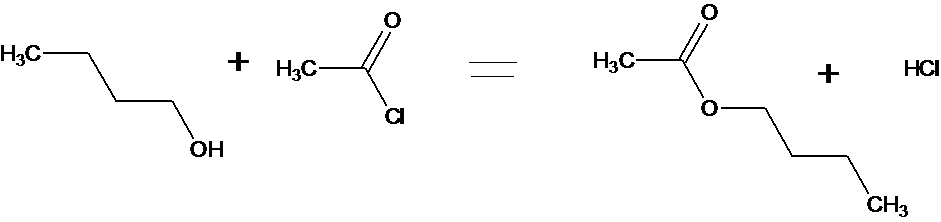
b- On obtiendrait le même ester ( éthanoate de butyl) et de l’eau.
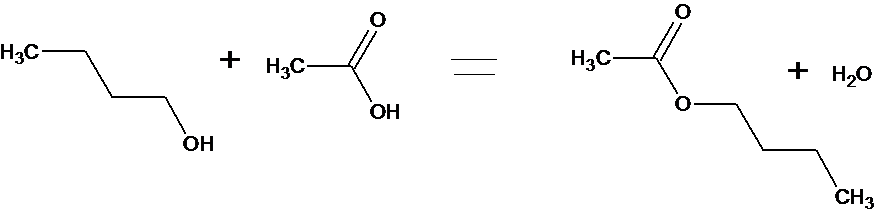
c- La réaction avec le Chlorure d’acyle est totale et rapide alors que celle avec l’acide carboxylique est lente et limitée.