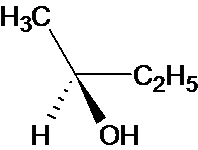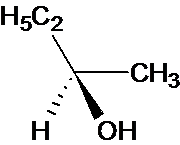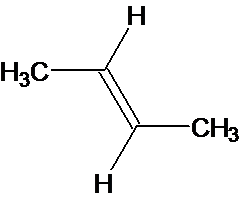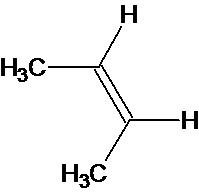Exercice n°3 ( BTS AB
2006)
On souhaite, en deux étapes, passer du but-1-ène au but-2-ène.
Dans un premier temps, le but-1-ène est hydraté à froid en milieu acide sulfurique dilué.
On obtient majoritairement un produit A.
1. Première étape.
1.1
Ecrire l’équation bilan conduisant au produit A, et nommer ce composé.
1.2
Détailler le mécanisme réactionnel de la réaction en justifiant la formation
majoritaire de A.
2. Le produit A possède des
stéréoisomères.
Représenter
ces différents stéréoisomères selon la représentation de cram,
et les distinguer selon la nomenclature R/S.
3. Le composé A est maintenant déshydraté en milieu acide sulfurique
concentré à 150 °C.
3.1
Etablir l’équation bilan de la réaction.
3.2
Nommer la règle qui permet de prévoir le produit majoritaire lors de cette
réaction.
4. Le but-2-ène présente une
stéréoisomérie.
Représenter
les deux stéréoisomères du but-2-ène, et les nommer.
Corrigé
1. Première étape :
1.1Equation bilan :
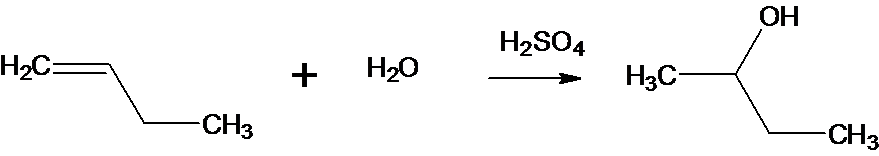
Le produit obtenu, A est le butan-2-ol.
1.2 Mécanisme réactionnel.
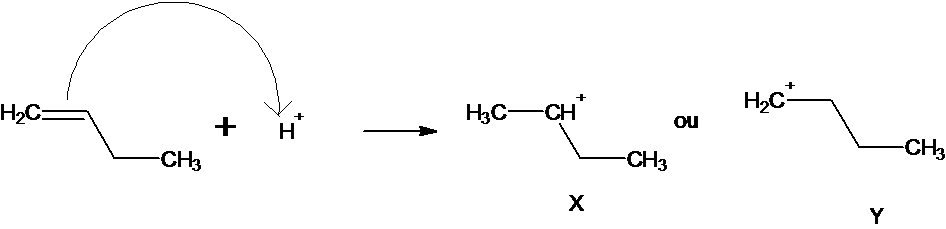
Le carbocation X est plus stable que Y, il est plus substitué par des
groupes alkyls donc plus stabilisé par effet inductif ( les
groupes alkyls sont des donneurs d’électrons). Il conduira donc au produit
majoritaire.
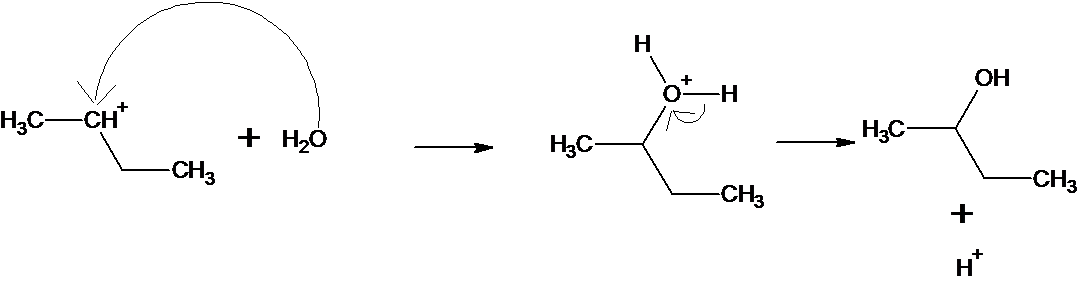
2. Le produit A possède des stéréoisomères.
|
|
|
|
(2S) Butan-2-ol |
(2R) Butan-2-ol |
3. Le composé A est maintenant déshydraté en milieu acide sulfurique
concentré à 150 °C.
3.1 Equation bilan :
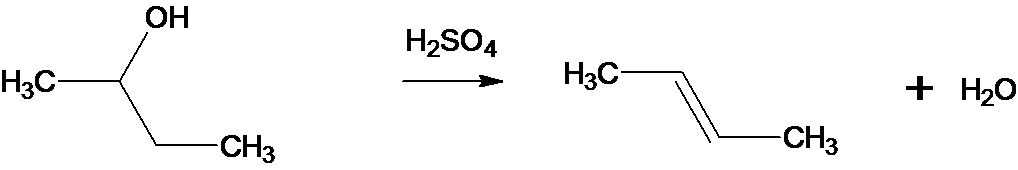
3.2 C’est la règle de Zaitsev qui permet de déterminer le composé
majoritaire : l’alcène le plus substitué.
4. Stéréo-isomères du but-2-ène.
|
|
|
|
(2,E) But-2-ène |
(2,Z) But-2-ène |
Ce sont des diastéréoisomères.