Exercice n°1
On fait réagir du benzène avec du monochlorométhane,
en présence de chlorure d’aluminium.
1.
Ecrire l’équation de la réaction. On appelle A le composé obtenu, donner son nom.
2.
De quel type de réaction s’agit-il ?
3.
Donner les différentes étapes de son mécanisme.
On réalise la mononitration de A.
4.
Quels réactifs utilise-t-on pour cette opération ?
5.
Ecrire l’équation de la réaction. Justifier l’obtention de 2
isomères
6.
Donner la formule de l’isomère B obtenu majoritairement.
7.
On oxyde B par le permanganate de potassium en milieu acide.
Ecrire les deux demi-équations électroniques puis l’équation de la réaction d’oxydo-réduction. Les couples rédox mis en jeu sont :
NO2-C6H4-COOH / B et MnO4- / Mn2+.
Corrigé
1. Equation de réaction :

A est le toluène ou méthylbenzène.
2. Il s’agit d’une substitution nucléophile.
3. Mécanisme réactionnel :
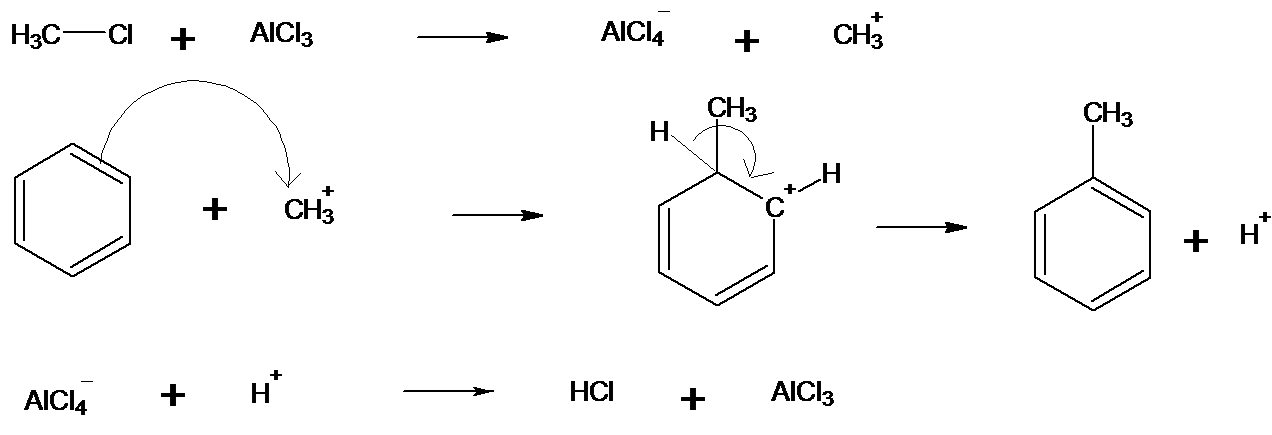
4. On emploie de l’acide nitrique en
présence d’acide sulfurique.
5. Equation de réaction :
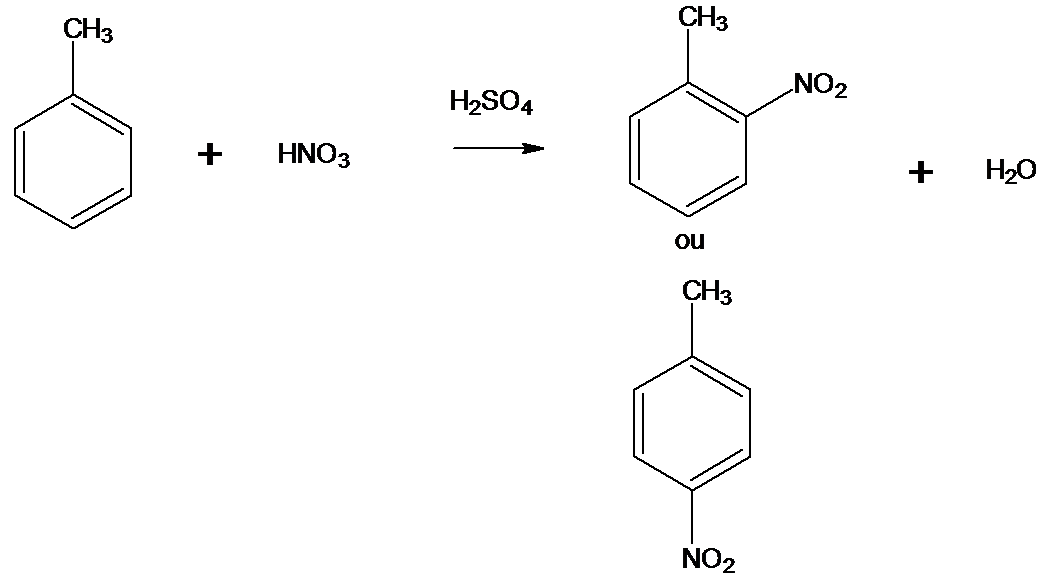
On obtient deux isomères, avec des orientations ortho et para car -CH3
est un substituant orientant en ortho et para.
6. Isomère majoritaire B :
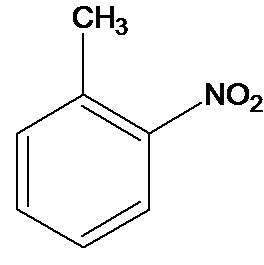
Le 1-méthyl-2nitrobenzène est majoritaire car
il y a deux sites possibles en ortho, contre un seul possible en para pour
fixer le groupe -NO2.
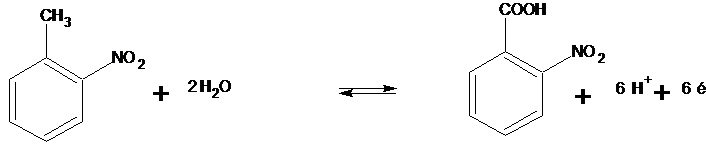
7. Demi-équations rédox :
(1) MnO4- + 8H+ + 5é = Mn2+ +
4 H2O
(2) 
Bilan : 6x (1) + 5x (2)
6 MnO4- + 18 H+ + 5 CH3-C6H4-NO2
= 6 Mn2+ + 14 H2O + 5 NO2-C6H4-COOH