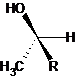Exercice n°3
On dispose dans un
laboratoire de la molécule A, le but-3-ènylbenzène,
dont la formule est la suivante :
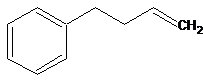
On réalise, alors, la série
de réactions successives ci-dessous :
Etape 1 : A + CH3Cl =
B (en présence de Chlorure
d’aluminium).
Etape 2 : B + H2O = C (En
milieu acide).
1.
Etape 1 :
1.1 Représenter la molécule B et lui donner un nom. Préciser, si
nécessaire, si on obtient un mélange de produits.
Donnée : Le groupe but-3-ènyl
a les propriétés électroniques d’un groupe alkyle (-R) en tant que substituant
du cycle aromatique.
1.2 Préciser le mécanisme réactionnel de cette réaction.
2. Etape 2 : On obtient
un mélange de produits au cours de l’étape 2, et non un seul. On nommera C1
le produit majoritaire et C2 le produit minoritaire.
2.1 Représenter les molécules C1 et C2.
Donnée : Le groupement C6H5CH3CH2- est assimilable à un groupe alkyle (-R).
2.2 À l’aide du mécanisme réactionnel de cette seconde étape,
justifier le caractère majoritaire de C1.
2.3 Représenter les différents isomères de
configurations de la molécule C1. Préciser leur configuration
absolue R ou S. Existe-t-il entre eux des relations d’énantiomérie
ou de diastéréoisomérie ?
Corrigé
|
|
|
|
1.1 |
On obtient un mélange de produits : B peut être : Le premier est orienté ortho (majoritaire), et le
second para, le groupement présent sur le benzène étant orienteur
ortho, para (groupe alkyle). |
|
1.2 |
Première étape : CH3Cl + AlCl3
→ + CH3+
AlCl4- Suite des étapes :
dernière étape : AlCl4-
+ H+ → HCl + AlCl3 |
|
2.1 |
C1 : |
|
2.2 |
R représente tout le groupe porté par la double
liaison. L’hydratation d’un alcène en milieu acide (HA, acide
fort) suit la règle de Markonikov.
Le carbocation le plus stable étant le plus
substitué (R est donneur d’électrons), c’est le second qui donnera le produit
majoritaire.
Le proton éliminé remplace celui de l’acide
initialement fourni, le catalyseur n’est pas consommé. |
|
2.3 |
Forme S : Ce sont des énantiomères, ils sont images l’un de
l’autre dans un miroir, mais non superposables. |
 ou
ou 
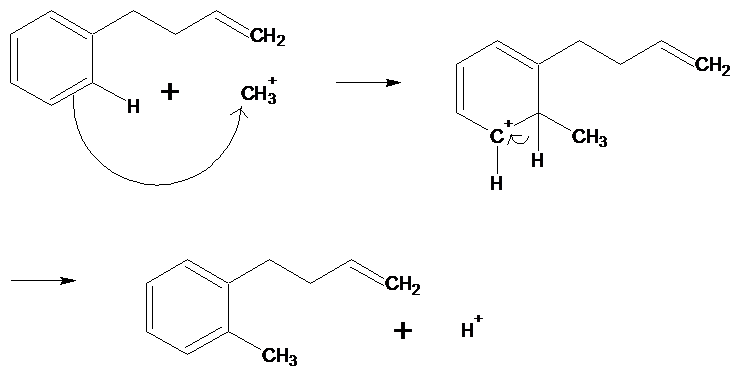
 C2 :
C2 : 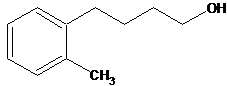
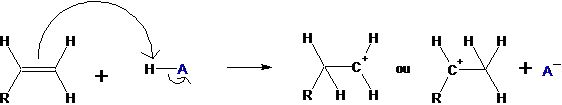
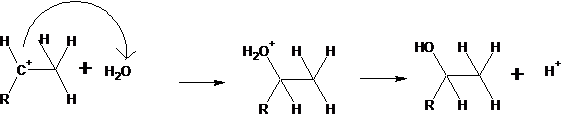
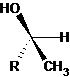 .
.