Exercice n°1
On prélève 10 mL d’une
solution d’acide chlorhydrique de concentration 0.050 mol.L-1 que
l’on met dans un bécher. On dilue de manière à obtenir un volume total de 500 mL.
1- Déterminer
la concentration des ions après dilution.
2- Quelle est la conductivité de la solution contenue
dans le bécher ?
3- On ajoute à ce bécher 1.50g de chlorure de sodium
qu’on dissout totalement après agitation. Déterminer la nouvelle conductivité
de la solution.
Données : On donne les mobilités des ions suivants en unité
SI.
lCl- =
76.10-4. lNa+ =
50.10-4. lOH- =
198.10-4. lH3O+ =
350.10-4.
On donne les masses molaires suivantes :
MCl =
Corrigé
1. On a CHCl
= [H3O+] = [Cl-] = C1.V1/Vt = 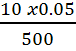 = 1.0
10-3 mol.L-1 = 1.0 10-3 x 1000 = 1.0 mol.m-3.
= 1.0
10-3 mol.L-1 = 1.0 10-3 x 1000 = 1.0 mol.m-3.
2. s = [H3O+].lH3O+ + [Cl-].lCl- = 1.0x350 10-4 + 1.0x76
10-4 = 4.3 10-2 S.m-1.
3. On a NaCl = Na+
+ Cl- dans l’eau. Et nNaCl = 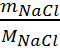 = 2.56
10-2 mol.
= 2.56
10-2 mol.
On
peut recalculer les concentrations des différents ions en solution :
[Cl-]’ = 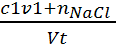 =
= 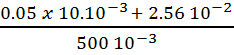 =
5.2 10-2 mol.L-1 = 5.2 10-2x1000 = 52 mol.m-3.
=
5.2 10-2 mol.L-1 = 5.2 10-2x1000 = 52 mol.m-3.
[H3O+] = C1.V1/Vt = 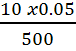 = 1.0
10-3 mol.L-1 = 1.0 10-3 x 1000 = 1.0 mol.m-3.
= 1.0
10-3 mol.L-1 = 1.0 10-3 x 1000 = 1.0 mol.m-3.
[Na+]
= ![]() =
5.1 10-2 mol.L-1 = 5.1 10-2x1000 = 51 mol.m-3.
=
5.1 10-2 mol.L-1 = 5.1 10-2x1000 = 51 mol.m-3.
4. Donc s = [H3O+].lH3O+ + [Cl-]’.lCl- + [Na+].lNa+ = 1.0x350 10-4 + 52x76 10-4
+ 51x50.10-4= 0.69 S.m-1.