Exercice n°2
Une
solution d’ammoniaque (NH4+/NH3 ;
l’ammoniaque est une base faible) est dosée par une solution d’acide
chlorhydrique à 10-1 mol.L-1.
1- Ecrire les équations de mise en solution puis
l’équation de réaction du dosage.
2- Ce dosage est suivi par conductimétrie. Les résultats,
lorsqu’on dose 20 mL de la solution d’ammoniaque, sont dans le tableau
ci-dessous. En début de dosage on a amené le bécher à 250 mL avec de l’eau
distillée.
|
V (ml) |
0 |
1 |
2 |
3 |
4 |
5 |
||
|
σ
(S.m-1) |
2.0 10-3 |
6.0 10-3 |
1.0 10-2 |
1.4 10-2 |
1.9 10-2 |
2.3 10-2 |
||
|
V (mL) |
6 |
7 |
8 |
9 |
9.5 |
10 |
||
|
σ (S.m-1) |
2.9 10-2 |
3.2 10-2 |
3.6 10-2 |
4.1 10-2 |
4.3 10-2 |
4.5 10-2 |
||
|
V (ml) |
10.5 |
11 |
12 |
13 |
14 |
15 |
||
|
σ
(S.m-1) |
4.9 10-2 |
5.3 10-2 |
6.2 10-2 |
7.0 10-2 |
7.9 10-2 |
8.7 10-2 |
||
|
V (mL) |
16 |
17 |
18 |
19 |
20 |
|
||
|
σ (S.m-1) |
9.6 10-2 |
10.4 10-2 |
11.3 10-2 |
12.2 10-2 |
13.0 10-2 |
|
||
2-1 Représenter la courbe σ en fonction de V.
2-2 Justifier l’allure de la courbe obtenue.
2-3 Etablir le tableau d’avancement, puis calculer la concentration
molaire de la solution d’ammoniaque.
2-4 Quelles sont les concentrations des différentes espèces chimiques à
l’équivalence ? En déduire la conductivité de la solution à l’équivalence.
2-5 Faire un schéma légendé du montage.
2-6 Pour réaliser ce dosage on a mis l’ammoniaque dans un bécher puis
on a ajouté de l’eau distillée afin d’obtenir un grand volume de solution.
Pourquoi à t’on fait cela?
Données : lCl- =
76.10-4. lNH4+ =
74.10-4. lOH- =
198.10-4. lH3O+ =
350.10-4. Unités S.m2.mol-1.
Corrigé
1. Equations de réactions :
Mises en solutions : HCl + H2O = H3O+ + Cl-
(totale) NH3 + H2O
= NH4+ + OH- (limitée)
Dosage : H3O+ + NH3 = NH4+
+ H2O (totale)
2. Tracé de la courbe :
2.1
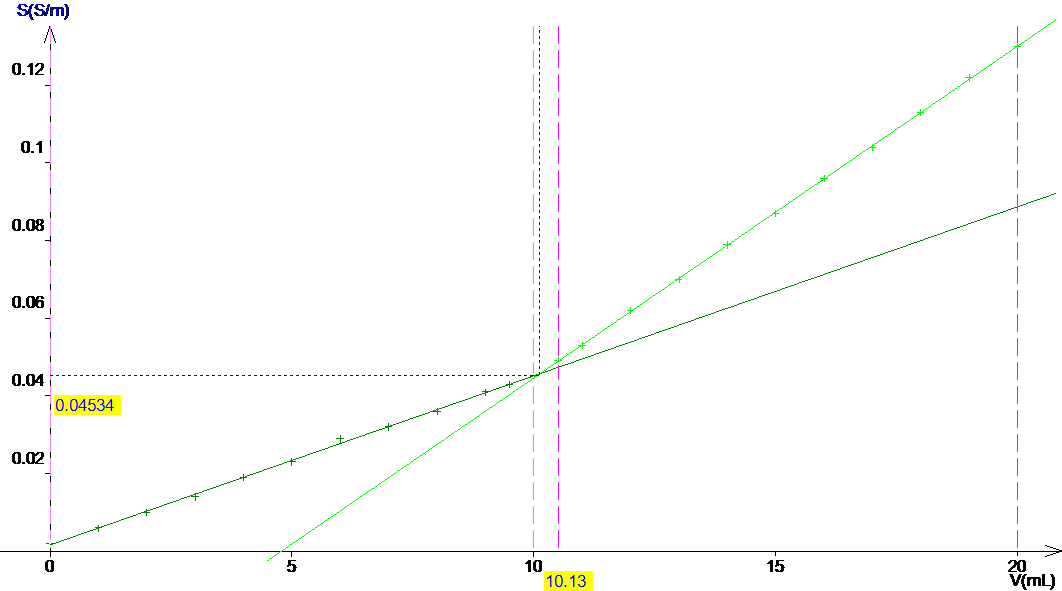
On obtient, par construction de l’intersection des deux demi-droites Veq
= 10.1 mL.
2.2 interprétation :
Première partie : D’après l’équation de réaction on fait apparaitre des
ions NH4+ et on
apporte des ions Cl- en solution donc la conductivité augmente.
Deuxième partie : On a dépassé l’équivalence, donc il n’y a plus
réaction. On apporte donc directement en solution des ions H3O+
et Cl- donc la conductivité augmente. Comme l H3O+ >> lCl- la conductivité de la
solution augmente plus vite que dans la partie (1).
2.3 tableau d’avancement :
|
|
H3O+
+ |
NH3
= |
NH4+ |
+ H2O |
|
EI |
nv |
n0 |
0 |
excès |
|
EF |
nv-x
=0 |
n0-x
= 0 |
x |
excès |
On a nv-x =0
et n0-x = 0 donc nv = n0 = x.
Soit [H3O+].Veq
= [NH3].E et [NH3] = 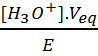 = 0.051
mol.L-1.
= 0.051
mol.L-1.
2.4 détermination des concentrations et
de la conductivité à l’équivalence.
On admet que les ions H3O+
et OH- sont en quantité négligeable à l’équivalence (pH ![]() . Il reste donc en solution des ions NH4+
et des ions Cl-.
. Il reste donc en solution des ions NH4+
et des ions Cl-.
On a [NH4+]=![]() =
= 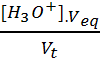 =
= 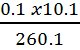 = 3.9
10-3 mol.L-1 = 3.9 mol.m-3.
= 3.9
10-3 mol.L-1 = 3.9 mol.m-3.
[Cl-] = ![]() =
= 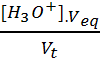 =
= 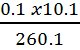 = 3.9
10-3 mol.L-1=3.9 mol.m-3. Puisqu’on a versé
autant de Cl- que d’ions H3O+ et que les ions
Cl- n’ont pas réagi.
= 3.9
10-3 mol.L-1=3.9 mol.m-3. Puisqu’on a versé
autant de Cl- que d’ions H3O+ et que les ions
Cl- n’ont pas réagi.
Donc la conductivité est : s = [NH4+].lNH4+ + [Cl-].lCl- = 3.9x74 10-4 + 3.9x76 10-4
= 5.9 10-2 S.m-1.
2.5 Schéma du montage :
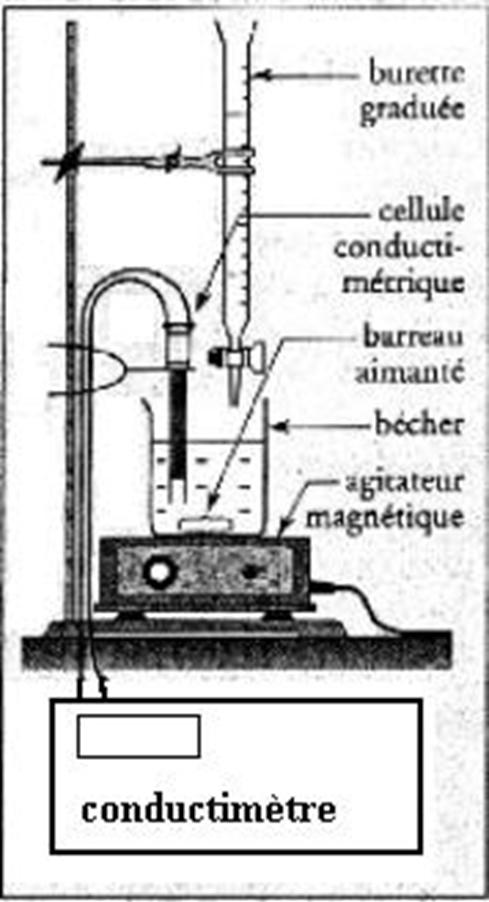
2.6 On a ajouté un volume d’eau distillée
important afin de pouvoir négliger la variation de volume de la solution dans
le bécher entre le début du dosage et sa fin (Ce volume intervient sur les
concentrations des ions et donc sur les conductivités, si sa variation est
négligeable, ce facteur ne varie pas et donc n’intervient pas au cours de l’expérience).