Exercice n°3
On dispose
de deux flacons non identifiés. L’un d’eux contient une base forte, de la soude
et l’autre une base faible : de l’ammoniaque. Afin de les identifier et
d’en connaître la concentration, on a dosé 10 mL de
la solution contenue dans chacun de ces flacons par conductimétrie
à l’aide d’acide chlorhydrique de concentration C1 = 1.00 mol.L-1. Au début du dosage, dans les deux cas,
on a amené le bécher à 250 mL à l’aide d’eau
distillée.
On obtient
les courbes données ci-dessous pour les deux dosages.
1.
Ecrire les
équations de mise en solution (dans l’eau) de l’acide chlorhydrique, de
l’ammoniaque et de l’hydroxyde de sodium.
2.
2.1.
Ecrire l’équation
de dosage de la soude par l’acide chlorhydrique.
2.2.
Etablir une
formule littérale indiquant la concentration de cette base CNaOH,
en fonction du volume d’acide versé à l’équivalence V1 et de la
prise d’essai E.
3.
3.1.
Ecrire l’équation
de dosage de l’ammoniaque par l’acide chlorhydrique.
3.2.
Etablir une
formule littérale indiquant la concentration de cette base, CNH3, en
fonction du volume d’acide versé à l’équivalence V1’ et de la prise d’essai E.
4.
4.1.
Que représente
« σ » sur les graphiques ? Expliciter l’unité
« S/m ».
4.2.
D’après l’allure
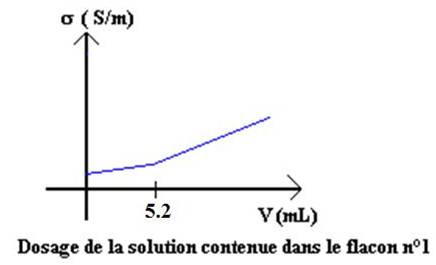
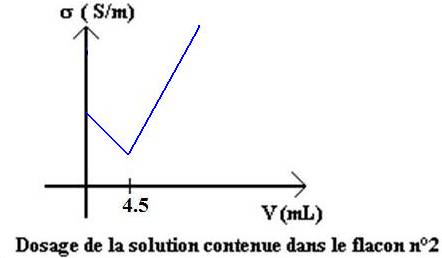
des deux courbes, attribuer un nom à chaque flacon.
4.3.
Commenter
l’allure de la courbe représentant le dosage de la soude par l’acide
chlorhydrique.
4.4.
Commenter
l’allure de la courbe représentant le dosage de l’ammoniaque par l’acide
chlorhydrique.
5.
Expliquer
pourquoi on a ajouté 250 mL d’eau distillée dans le
milieu réactionnel en début d’expérience ?
6.
Déterminer les
valeurs des concentrations des deux solutions de bases.
Conductivités
molaires des ions, λ, en S.m2.mol-1.
|
Na+ |
H3O+ |
OH- |
NH4+ |
Cl- |
|
50.10-4 |
350.10-4 |
200.10-4 |
74.10-4 |
76.10-4 |
Corrigé
1. Mises en solution.
HCl + H2O = H3O+ + Cl- cette
réaction est quasi-totale.
NH3
+ H2O = NH4+ + OH- cette réaction
est limitée.
H2O
NaOH = Na+ + OH-
cette réaction est quasi-totale.
2. Dosage de la
soude par l’acide chlorhydrique :
2.1 H3O+ + OH- = 2 H2O.
|
|
H3O+ + |
OH- |
= 2 H2O |
|
EI |
nHCl |
nsoude |
Excès |
|
EF (équivalence) |
nHCl –x = 0 |
nsoude-x=0 |
Excès |
2.2 A l’équivalence, x = nHCl
= nsoude donc : CHCl.E
= C1.V1 soit CHCl= C1.V1/E.
3. Dosage de l’ammoniaque par l’acide.
3.1
|
|
H3O+ + |
NH3 |
= NH4+ |
+ H2O |
|
EI |
nHCl |
NNH3 |
0 |
Excès |
|
EF (équivalence) |
nHCl –x = 0 |
NNH3-x=0 |
x |
Excès |
3.2
A l’équivalence, x = nNH3 = nHCl
donc : CNH3.E = C1.V1’ soit CNH3=
C1.V1’/E.
4. Conductivité.
4.1 σ, représente la conductivité de la solution, elle
se mesure en siemens (S) par mètre (m).
4.2
La
première courbe est caractéristique du dosage d’une base faible par un acide
fort : le flacon n°1 contient donc de l’ammoniaque. La seconde,
caractéristique du dosage d’une base forte, permet d’attribuer le flacon n°2 à
la soude. Les questions suivantes permettront de compléter cette justification.
4.3
Dosage
de la soude par l’acide chlorhydrique :
La courbe obtenue pour le flacon n°2 (dosage de l’acide
chlorhydrique) est constituée de deux parties : une portion de droite décroissante de pente raide (1) et une portion de
droite croissante de pente plus faible (2).
La partie (1) correspond à la disparition des ions OH-
au cours du dosage H3O+ + OH- = 2 H2O qui a lieu avant l’équivalence.
Ils sont bien remplacés par l’apport d’ions Cl- mais ces derniers
ont une conductivité molaire nettement plus faible, ce qui explique la chute de
conductivité dans cette première partie.
Après
l’équivalence, on passe à la partie (2), il n’y a plus réaction et donc
uniquement apport en solution d’ions H3O+ et Cl-,
ceci explique l’augmentation de la conductivité de la solution. Comme les ions
H3O+ conduisent mieux que les ions OH-, la
valeur de la pente est plus importante que celle de la partie (1).
4.4 Dosage de l’ammoniaque par l’acide
chlorhydrique :
La courbe obtenue pour le flacon n°1 (dosage de l’ammoniaque)
est constituée de deux parties : une portion de droite croissante de pente
faible (1) et une portion de droite croissante de pente plus importante (2).
La partie (1) correspond à l’apparition des ions NH4+
au cours du dosage NH3+ H3O+ = NH4+
+ H2O qui a lieu avant l’équivalence ainsi qu’à l’apport des ions Cl-.
Après
l’équivalence, on passe à la partie (2), il n’y a plus réaction et donc uniquement
apport en solution d’ions H3O+ et Cl-, ceci
explique l’augmentation de la conductivité de la solution. Comme les ions H3O+
conduisent mieux que les ions NH4+, la valeur de la pente
est plus importante que celle de la partie (1).
5. On a ajouté de l’eau distillée afin que la
variation de volume au cours de l’expérience soit négligeable. Si cette
variation n’est pas négligeable, on n’obtient pas des portions de droites mais
des courbes et on est obligé de « corriger » les valeurs pour obtenir
des segments de droites et lire l’équivalence. Ceci vient du fait que la
conductance dérive de la conductivité de la solution, elle même liée aux
concentrations des ions donc au volume de la solution.
6. Détermination
des concentrations :
On peut lire les volumes équivalents sur les courbes.
Flacon n°1, dosage de l’ammoniaque :
CNH3= C1.V1’/E = 1.00 x 5.2
/ 10.0 = 5.2 10-1 mol.L-1.
Flacon n°2, dosage de la soude :
Csoude= C1.V1/E = 1.00 x 4.5 / 10.0 = 4.5 10-1
mol.L-1.