Exercice n°4
On dose une
solution d’ammoniaque de concentration Cb par une solution d’acide
chlorhydrique. La solution à doser est introduite dans la burette.
On verse dans le bécher 10
mL d’acide chlorhydrique de concentration ca = 0.100 mol.L-1
auxquels on ajoute 90 mL d’eau distillée. On suit l’évolution de la
conductance, G au cours du dosage.
|
VNH3 (mL) |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
|
G (mS) |
4.26 |
3.75 |
3.05 |
2.50 |
1.95 |
1.50 |
1.52 |
1.47 |
1.50 |
On
donne :
La constante de cellule
est k = 10-2m.
Conductivités
molaires des ions, λ, en S.m2.mol-1.
|
Na+ |
H3O+ |
OH- |
NH4+ |
Cl- |
|
50.10-4 |
350.10-4 |
200.10-4 |
74.10-4 |
76.10-4 |
1. Tracer le graphe G= f(V).
2. Ecrire l’équation de la réaction de dosage.
3. Interpréter l’allure de la courbe obtenue.
4. Déterminer la concentration Cb de la
solution S
5. Expliquer pourquoi on a joute 90 mL d’eau distillée à
la solution d’acide chlorhydrique contenue dans le bécher.
6. Conductivité, conductance :
6.1
Préciser les
unités, dans le système international, des grandeurs intervenant dans
l’expression de la conductivité s.
6.2
Exprimer la
conductivité de la solution du bécher pour VNH3 = 0 mL. Calculer sa
valeur théorique et en déduire celle de la conductance correspondante.
6.3
La conductance
est constante à partie de l’équivalence, déterminer sa valeur théorique.
Corrigé
I
Conductivité.
1.
Courbe :
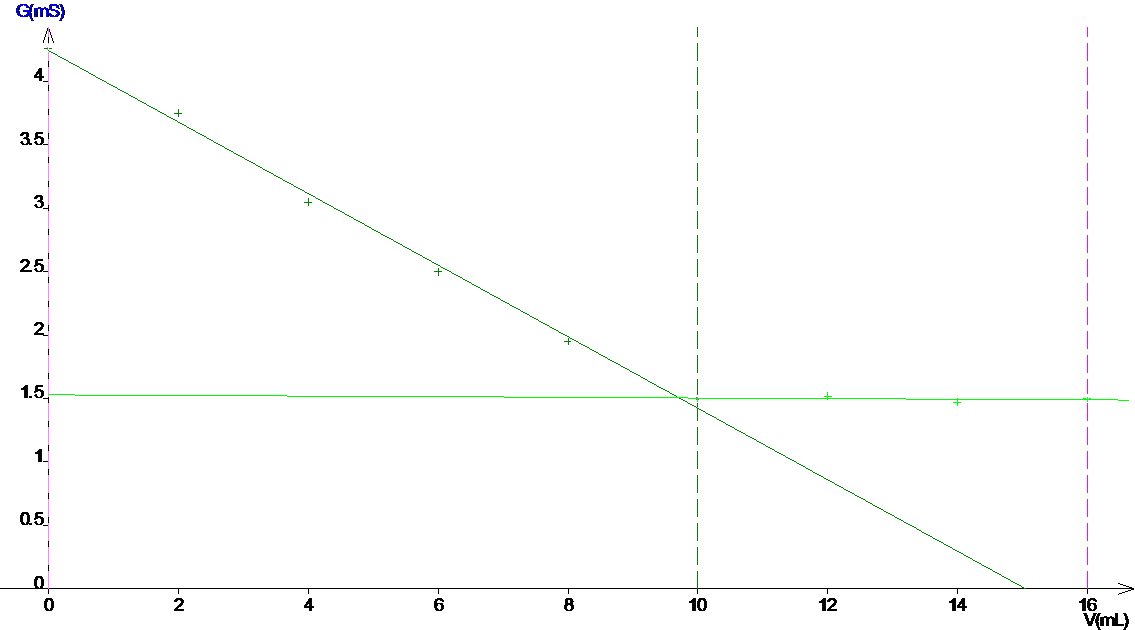
Veq = 9.7 mL et Geq = 1.50 mS.
2.
NH3 +
H3O+ = NH4+ + H2O.
3.
Le graphe est
composé de deux segments de droite : Le premier est décroissant, le second
sensiblement constant. Dans la première partie du dosage, avant l’équivalence,
on fait disparaître des ions hydroniums (H3O+) et
apparaître des ions ammoniums (NH4+). Les ions hydronium
sont beaucoup plus conducteurs que les ions ammoniums, ce qui explique la chute
de la conductivité de la solution et donc de la conductance. Dans la deuxième
partie, après l’équivalence, on se contente d’apporter des molécules d’ammoniac
à la solution, elles sont non conductrices, ce qui explique la stagnation de G.
4.
On a
|
|
H3O+ + |
NH3 |
= NH4+ |
+ H2O |
|
EI |
n0 |
nv |
0 |
Excès |
|
EF (équivalence) |
n0 –x = 0 |
nv-x=0 |
x |
Excès |
n0 –x = 0 et nv-x=0 donc n0
= nv = x avec n0 = [H3O+] Vacide
et nv = [NH3]. Veq.
[NH3] = [H3O+] Vacide
/ Veq = 1.03 10-1 mol.L-1.
5.
On a ajouté de
l’eau distillée afin que la variation de volume au cours de l’expérience soit
négligeable. Si cette variation n’est pas négligeable, on n’obtient pas des
portions de droites mais des courbes et on est obligé de « corriger »
les valeurs pour obtenir des droites et lire l’équivalence. Ceci vient du fait
que la conductance dérive de la conductivité de la solution, elle même liée aux
concentrations des ions donc au volume de la solution.
6.
1- Zi :
charge de l’ion. sans unité. Λi : S.m2.mol-1.
Ci : mol.m-3.
6. 2- s = l1C1 + l2C2 = z1 Λ1 C1
+ z2 Λ2 C2. Où 1 représente l’ion H3O+
et 2 représente l’ion Cl- (C1 = C2 = 0.01 mol.L-1
(dans 100 mL) = 10 mol.m-3). s = 0.426 S.m-1. G = k. s = 4.26 10-3 S.
6. 3- À l’équivalence on n’a plus aucun réactif, la
conduction est donc assurée par les ions Cl- et NH4+
formés.
D’après le tableau d’avancement ci-dessus :
[NH4+]EF
= x/V = n0 /V = 0.01 mol.L-1 (dans environ 100 mL) soit
10 mol.m-3. Et [Cl-] = n0/V =0.01 mol.L-1
= 10 mol.m-3. (On a mis, au départ, une quantité n0 d’ions
Cl-).
Donc s = l1C1 + l2C2 = = z1 Λ1 C1
+ z2 Λ2 C2 = 1x74.10-4 x10 +
1x 76.10-4 x 10 = 0.15 S.m-1. G= k. s = 1.5 10-3 S.