Exercice n°5
On souhaite déterminer la
constante d’acidité Ka de l’acide méthanoïque HCOOH par conductimétrie. On
plonge la cellule conductimétrique dans une solution d’acide méthanoïque de
concentration c = 1.0 10-2 mol.L-1 et on trouve la
conductivité de la solution s = 5.10 10-2 S.m-1.
1. Ecrire les équations des équilibres ayant lieu en
solution.
2. Faire le bilan des espèces chimiques présentes en
solution et déterminer quelles sont les espèces majoritaires.
3. A l’aide d’un tableau d’avancement, donner
l’expression littérale du coefficient de dissociation, a, de l’acide méthanoïque.
4. Exprimer la conductivité, s, de la solution en fonction des concentrations des
ions à l’état final et en déduire la valeur numérique de a.
5. Déterminer les valeurs de Ka et pKa de cet acide.
6. On dose par conductimétrie l’acide méthanoïque
(bécher) par de la soude (burette). Ecrire l’équation du dosage.
7. Donner l’allure de la courbe obtenue s = f(V) et la justifier qualitativement.
Conductivités
molaires des ions, λ, en S.m2.mol-1.
|
Na+ |
H3O+ |
OH- |
HCOO- |
|
50.10-4 |
350.10-4 |
200.10-4 |
50.10-4 |
Corrigé
1. En solution deux équilibres ont lieu :
HCOOH + H2O = HCOO- + H3O+
(limité)
2 H2O = H3O+ + OH- (limité) l’autoprotolyse
de l’eau peut être négligée dans la suite puisque l’acide n’est pas très dilué.
2. En conséquence les espèces
majoritaires sont HCOOH (acide faible relativement peu dissocié), puis HCOO-
et H3O+ qui sont les seules espèces conductrices. Bien
sur, l’eau, qui compose le solvant, est ultramajoritaire.
3. Tableau d’avancement : Dans V =
1L =0.001 m3
|
|
HCOOH |
+H2O |
= HCOO- |
+ H3O+ |
|
EI |
n0 =0.01 mol |
excès |
0 |
0 |
|
EF |
n0-x |
excès |
x |
x |
On a donc en état final :
[H3O+]EF = [HCOO-]EF
= x/V et [HCOOH]EF = ![]()
Par définition, a = ![]()
4. s = [HCOO-]EF.lHCOO- + [H3O+]EF.
.lH3O+ = ![]() (.lHCOO- + lH3O+) donc x =
(.lHCOO- + lH3O+) donc x = 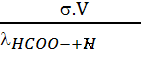 =
= 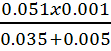 =1.3 10-3 mol
=1.3 10-3 mol
Donc
a = ![]() =
1.3 10-3/ 0.01 = 1.3 10-1.
=
1.3 10-3/ 0.01 = 1.3 10-1.
5. Ka
= 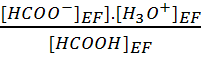 =
= 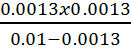 = 1.9
10-4 et pKa = -Log Ka = 3.7
= 1.9
10-4 et pKa = -Log Ka = 3.7
6. On obtient HCOOH + OH- = HCOO-
+ H2O (totale).
7. On obtient la courbe suivante :
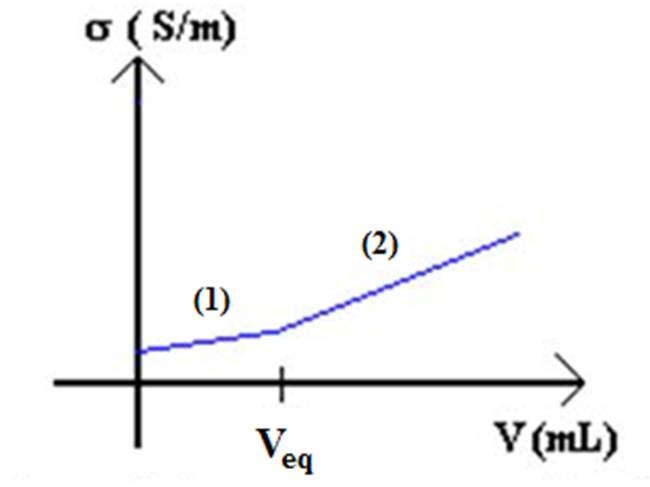
Interprétation :
t Partie (1) : D’après l’équation de réaction on
fait apparaitre des ions HCOO- et
on apporte des ions Na+ en solution donc la conductivité
augmente.
t Partie (2) : On a dépassé l’équivalence, donc
il n’y a plus réaction. On apporte donc directement en solution des ions OH-
et Na+ donc la conductivité augmente. Comme l OH- >> l HCOO- la conductivité de
la solution augmente plus vite que dans la partie (1).