Exercice n°6 (BTS biochimiste (BIOAC) 1998)
Dans l’exercice suivant la
conductivité pourra être notée s au lieu de g comme dans l’énoncé
et la conductivité molaire pourra
être notéel.

Corrigé
1. Conductivité de la solution. Dans les
réponses de l’exercice, les conductivités seront notées s et les conductivités
molaires l.
1.1 On a les ions suivants en solution :
K+, Cl-, H3O+ et OH-.
la conductivité s = lK+[K+] + lCl-[Cl-] +lH3O+[H3O+] + lOH-[OH-].
1.2 On a les concentrations des ions
suivantes à pH = 7. 1 mol.L-1 = 1000 mol.m-3.
a- [K+] = 1 10-2 mol.L-1
= 10 mol.m-3
[Cl-]= 1 10-2 mol.L-1 = 10
mol.m-3
[H3O+] = [OH-]= 10-7
mol.L-1 = 10-4 mol.m-3 (on est à pH = 7 et [OH-]= [H3O+] =10-pH)
Les concentrations des
ions potassium et chlorures sont 105 fois plus élevées que celles
des ions hydroxydes et hydroniums, on peut donc négliger la conductivité due à
ces ions dont les conductivités sont tout au plus 5 fois plus élevées que
celles des premiers.
b- Calcul de la conductivité : s = lK+[K+] + lCl-[Cl-] or c = [Cl-]=
[K+] donc s = c(lK+ + lCl-) et la conductivité molaire de la
solution, donc pour c =1 mol.m-3 est égale à l = lK+ + lCl- = 1.498 10-2 S.m².mol-1
2. On obtient les résultats suivants : l = s/C
|
C
(mol.m-3) |
10.0 |
20.0 |
50.0 |
100 |
|
s (S.m-1) |
0.1413 |
0.2765 |
0.6640 |
1.265 |
|
l (S.m².mol-1) |
1.41 10-2 |
1.38 10-2 |
1.33 10-2 |
1.27 10-2 |
|
|
3.16 |
4.47 |
7.07 |
10.0 |
3. On obtient la courbe suivante. l = f(![]() )
)
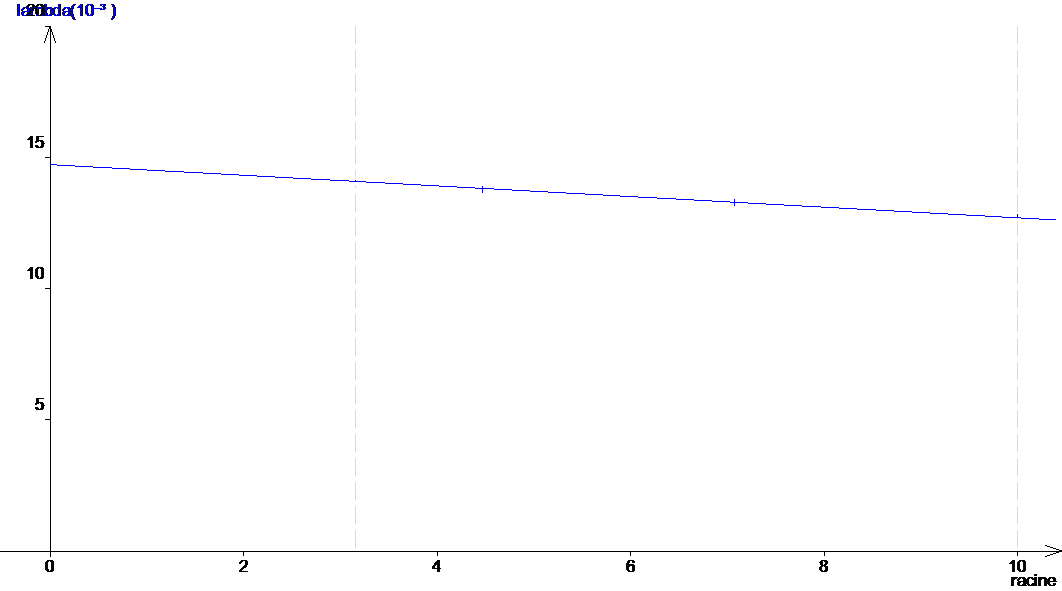
L’équation de la droite est l = 0.0147 – 0.000203 (![]() ). On en déduit que l0 = 0.0147 S.m².mol-1 (pour C = 0 mol.L-1
ce qui correspond à une solution infiniment diluée.).
). On en déduit que l0 = 0.0147 S.m².mol-1 (pour C = 0 mol.L-1
ce qui correspond à une solution infiniment diluée.).
4. On obtient la valeur de l0, donnée en conditions standards, en conditions
idéale, donc pour une solution infiniment diluée (voir thermodynamique). Les
valeurs données dans les tables sont données dans ces conditions.