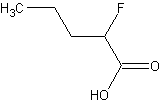
 est donc plus stable que celle de
est donc plus stable que celle de 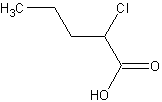 puisque la charge négative portée par le COO- est plus délocalisée.
puisque la charge négative portée par le COO- est plus délocalisée.Exercice n°2
La molécule la plus acide correspond à celle qui a la base conjuguée la plus stable. cette dernière étant stable, l'acide la forme d'autant plus facilement et est donc d'autant plus à même de libérer son proton.
Le fluor exerce un effet inductif attracteur, comme le Chlore, mais celui dû au fluor est plus important puisqu'il est plus electronégatif.
La base conjuguée de  est donc plus stable que celle de
est donc plus stable que celle de  puisque la charge négative portée par le COO- est plus délocalisée.
puisque la charge négative portée par le COO- est plus délocalisée.
De même la base conjuguée de 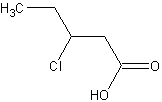 est un peu moins stable que les précédentes puisque l'effet inductif attracteur d'électrons dû au chlore se fait moins sentir au niveau du COO- car il est plus éloigné.
est un peu moins stable que les précédentes puisque l'effet inductif attracteur d'électrons dû au chlore se fait moins sentir au niveau du COO- car il est plus éloigné.
La base conjuguée de 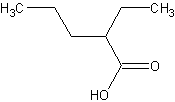 est déstabilisée par la présence du groupe alkyl, donneur d'électrons, qui renforce le caractère négatif du COO-, au lieu de répartir la charge comme dans les cas précédents.
est déstabilisée par la présence du groupe alkyl, donneur d'électrons, qui renforce le caractère négatif du COO-, au lieu de répartir la charge comme dans les cas précédents.
On peut donc classer les acides par ordre d'acidité croissant :
1 (le moins acide) 
2 
3 
4 (le plus acide) 