Exercice n°2
On
réalise une pile en plongeant une lame de zinc dans une solution de chlorure de
zinc telle que [Zn2+] = 0.10 mol.L-1 et une lame de
nickel dans une solution de chlorure de nickel telle que [Ni2+] =
0.10 mol.L-1. Les deux demi-piles sont reliées par un pont
électrolytique.
La
pile débite dans un conducteur ohmique.
1.
Faire un schéma de la pile sur lequel seront indiqués, les sens de
déplacement des électrons et du courant électrique à l’extérieur de la pile.
Déterminer la force électromotrice de cette pile.
2.
Ecrire l’équation de fonctionnement de cette pile.
Déterminer la constante d’équilibre de cette pile.
3.
Au bout d’un moment, la force électromotrice de la pile est E=0.45V.
Déterminer le rapport [Zn2+]/[Ni2+] à cet instant.
Données :
E0Zn2+/Zn
= -0.76 V et E0Ni2+/Ni = -0.25 V.
Corrigé
1- Schéma de la pile :
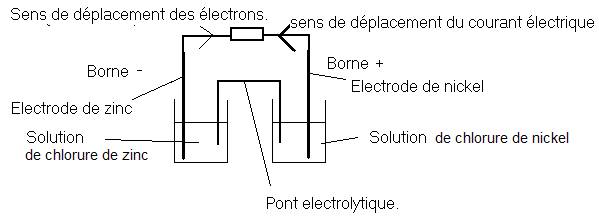
·
EZn =
E0 Zn2+/Zn + 0.06/2 Log [ Zn2+]
= - 0.79 V (borne négative, potentiel le plus bas ) (cf équation bilan du 2 )
·
ENi =
E0 Ni2+/Ni + 0.06/2 Log [ Ni2+]
= -0.28 V (Borne positive de la pile, potentiel le plus haut.)
(cf équation bilan du 2 )
·
Upile = E+ - E- =
-0.28—0.76 = 0.51 V
2- Equation bilan globale de fonctionnement :
·
Borne
positive : Ni2+ + 2 é = Ni
·
Borne
négative : Zn = Zn2+ + 2é .
·
Bilan : Zn + Ni2+ = Zn2+ + Ni
·
En supposant qu’il
s’agisse d’une réaction équilibrée, k serait définit par : k= [Zn2+] / [Ni2+] et
à l’équilibre,
Upile= 0 V.
·
Upile = E+ - E-
= E0 Ni2+/Ni
+ 0.06/2 Log [ Ni2+] – ( E0 Zn2+/Zn
+ 0.06/2 Log [ Zn2+] )
= E0
Ni2+/Ni -
E0 Zn2+/Zn + 0. 03 Log
[ Ni2+] – 0.03 Log [ Zn2+]
= Δ E0 + 0.03 Log [ Ni2+] / [ Zn2+]
Donc Log [ Ni2+] / [ Zn2+]
= (Upile - Δ E0 )/ 0.03 = - 17
Et [ Ni2+] / [ Zn2+] =
10-17
·
Donc K = 1017 ;
cela confirme que la réaction peut être considérée comme totale ( K très élevé
, en fin de réaction pratiquement tous les ions nickel ont disparus .)
3- Rapport des concentrations :
·
Upile = E+ - E-
= E0 Ni2+/Ni
+ 0.06/2 Log [ Ni2+] – ( E0 Zn2+/Zn
+ 0.06/2 Log [ Zn2+] )
= E0
Ni2+/Ni -
E0 Zn2+/Zn + 0. 03 Log [ Ni2+] – 0.03 Log [ Zn2+]
= Δ E0 + 0.03 Log [ Ni2+] / [ Zn2+]
Donc Log [ Ni2+] / [ Zn2+]
= (Upile - Δ E0 )/ 0.03 = - 2
Et [ Ni2+] / [ Zn2+] =
10-2