Exercice n°5
Dans
cet exercice, les valeurs numériques calculées seront données avec 3 chiffres
significatifs
On
réalise une pile avec les deux demi-piles suivantes : Pb/Pb2+ // H+ / ClO3-
/ Cl-/ Pt
1) a) Écrire la demi-équation
électronique correspondant au couple ClO3-/ Cl- en
milieu acide.
b)
Calculer le potentiel pris par un fil de platine plongeant dans une solution contenant
0,200 mol.L-1 d'ions ClO3- ,
0,180 mol.L-1 d'ions Cl-,
et de pH = 1.
2) a) Écrire la demi-équation
électronique correspondant au couple Pb2+ / Pb.
b)
Calculer le potentiel pris par une lame de plomb plongeant dans une solution de
nitrate de plomb de concentration
0,500 mol.L-1.
3) Calculer la force
électromotrice de la pile au début de son fonctionnement
4) On réalise une pile avec
les deux demi-piles précédentes :
Faire un schéma de cette pile.
Préciser les réactions qui s'effectuent dans chaque
demi-pile et l'équation de fonctionnement de la pile.
Où s’effectue la réaction de réduction ? La
réaction d’oxydation ?
Préciser les pôles positif et négatif de la pile,
justifier la réponse.
Préciser le sens du courant, le sens de circulation
des électrons.
5)
Au bout de 30 min, il a disparu 0,150 mol.L-1 d’ions ClO3-.
Au cours de cette transformation, le volume de
chaque compartiment (100mL) reste constant.
A l’aide d’un tableau d’avancement, déterminer les
concentrations des ions présents.
La solution étant très acide, on admet que les ions
H+ sont introduits en large excès et donc que leur concentration ne
varie pas.
Calculer la force électromotrice de la pile à ce
moment là.
6)
Expliquer à quel moment une pile arrête de fonctionner ; on dit alors que
la pile est usée.
Données : E0 (ClO3- / Cl-)
= 1,450 V E0 (Pb2+
/ Pb) = - 0,126 V.
Corrigé
1- Première
demi-pile.
a- ClO3- + 6H+
+6e =
Cl- + 3H2O
b-
On
a EPt = E0ClO3-/Cl- + ![]() = 1.39V
= 1.39V
2- Deuxième
demi-pile :
a-
Pb2+
+ 2e = Pb
b-
EPb
= E0Pb2+/Pb + ![]() Log [Pb2+] = -0.135V
Log [Pb2+] = -0.135V
3- on a Epile
= E+ - E- = EPt – EPb = 1.53 V
4- Schéma :
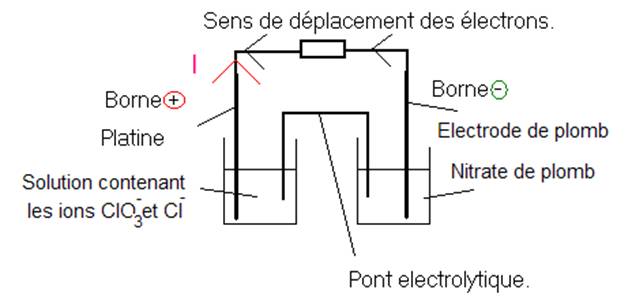
A la borne
négative, on fournit des électrons : (1) Pb = Pb2+ + 2e Il s’agit
d’une oxydation.
A la borne
positive, on consomme des électrons : (2) ClO3- + 6H+
+6e =
Cl- + 3H2O Il s’agit d’une réduction.
Equation de
fonctionnement : 3x(1) + (2)
3Pb + ClO3-
+ 6H+ = 3Pb2+ + Cl- + 3H2O
5- Tableau d’avancement :
Dans 100 mL Il a disparu 0.015 mol de ClO3- donc
x=0.015 mol
|
|
3Pb + |
ClO3-
+ |
6H+
= |
3Pb2+
+ |
+ Cl-
+ |
3H2O |
|
EI |
Excès
(solide) |
n0 =cv
=0.1x0.2 =0.02 mol |
Excès pH=1 |
n1=
cv = 0.1x0.5 =0.05 mol |
n2=cv
=0.1x0.18 =0.018mol |
Excès |
|
EF |
Excès |
n0-x
= 0.02-0.015 =0.005 mol |
Excès pH=1 |
n1+3x
= 0.095 mol |
n2+x
= 0.023 mol |
Excès |
Donc en état
final :
[ClO3-]EF
= ![]() = 0.05 mol.L-1
= 0.05 mol.L-1
[Pb2+]EF
= ![]() = 0.95 mol.L-1
= 0.95 mol.L-1
[Cl-]EF
= ![]() = 0.23 mol.L-1
= 0.23 mol.L-1
Afin de
déterminer la force électromotrice de lapilen il faut recalculer les deux
potentiels :
EPt
= E0ClO3-/Cl- + ![]() = 1.38V
= 1.38V
EPb
= E0Pb2+/Pb + ![]() Log [Pb2+] = -0.127V
Log [Pb2+] = -0.127V
Epile
= E+ - E- = EPt – EPb = 1.51 V
6- La pile
arrête de fonctionner lorsqu’un des réactifs est complètement consommé. On a
alors égalité des potentiels des deux électrodes et une différence de potentiel
nulle.