Exercice n°6
On
considère la pile représentée ci-dessous :
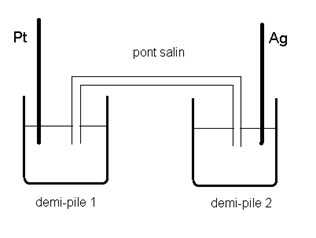
La
demi-pile 1 est constituée d’une électrode de platine plongeant dans une
solution de permanganate de potassium (K+,MnO4-)
acidifiée dans laquelle :
[MnO4-] =
0,01 mol/L; [Mn2+] = 0,02 mol/L; [HO3+] =
0,08 mol/L.
La
demi-pile 2 est constituée d’une électrode d’argent plongeant dans une solution
de nitrate d’argent (Ag+,NO3-) de
concentration O,1 mol/L.
1-Exprimer
puis calculer la conductivité de la solution de nitrate d’argent
2-Exprimer
puis calculer les potentiels des électrodes de platine et d’argent.
3-Calculer
la force électromotrice en début de fonctionnement
4-Ecrire
les réactions se produisant à chacune des électrodes et en déduire l’équation
bilan lorsque la pile débite.
5-Comment
évoluent les concentrations des espèces ioniques quand la pile débite ?
6-Au
bout de 30 minutes d’utilisation la concentration en ions permanganate MnO4-
est égale à 0,005 mol/L. Calculer les concentrations en ions Mn2+ et
H30+ au bout de 30 minutes d’utilisation.
Données
à 25°C :
E°( MnO4-/ Mn2+) = 1,51
V E°(Ag+/Ag) = 0,8
V
lAg+) = 62.10-4 S.m2.mol-1 et l(NO3-) = 72.10-4 S.m2.mol-1
Corrigé
1- On a s = lNO3- [NO3-]
+ lAg+ [Ag+] les concentrations
sont exprimées en mol.m-3.
s = 72.10-4x100
+ 62.10-4x100 = 1.34 S.m-1
2- On a Ag+
+ e = Ag et EAg = E0Ag+/Ag + 0.06/1 Log [Ag+]
= 0.74V
On a MnO4-
+ 8H+ +5e = Mn2+ + 4H2O et EPt
= E0MnO4-/Mn2+ + ![]() = 1.40V
= 1.40V
3- On a Epile
= E+ - E- = EPt – EAg =0.66V
4- L’électrode
d’argent a le plus bas potentiel, ce qui justifie qu’elle soit l’électrode
négative.
A la borne
moins, on produit des électrons : (1) Ag = Ag+ + e
A la borne
positive, on consomme des électrons : (2) MnO4- + 8H+
+5e = Mn2+ + 4H2O
Equation de
fonctionnement : 5x(1) + (2) 5Ag + MnO4- + 8H+ = 5Ag+
+ Mn2+ + 4H2O
5- Les
réactifs disparaissent et les produits sont formés : les concentrations en
ions permanganate et hydronium diminuent alors que les concentrations en ions
argent et manganèse augmentent.
6- Tableau d’avancement :
Dans V=1L
|
|
5Ag + |
MnO4-
+ |
8H+ = |
5Ag+ |
+ Mn2+ |
+ 4H2O |
|
EI |
Excès
(solide) |
n0 =
0.01 mol |
n1
= 0.08 mol |
n2=
0.1 mol |
n3=
0.02 mol |
Excès |
|
EF |
Excès |
n0-x
= 0.005 mol |
n1-8x =
0.04 mol |
n2+5x =
0.125 mol |
n3+x =
0.025 mol |
Excès |
Détermination
de x : n0-x = 0.005 soit x = n0 -0.005 = 0.005 mol
Soit dans un
volume de 1L :
[H3O+]
= [H+] = ![]() = 4.10-2mol.L-1.
= 4.10-2mol.L-1.
[Mn2+]
= ![]() = 2.5 10-2 mol.L-1
= 2.5 10-2 mol.L-1