Exercice n°1
On dispose d’une solution mère de sulfate de cuivre à 1 mol.L-1. On en réalise diverses dilutions dont on mesure l’absorbance pour la longueur d’onde 655 nm qui correspond au maximum de la courbe A = f(l) pour une solution de sulfate de cuivre.
La largeur de la cuve est de 1cm.
On obtient le tableau suivant :
|
C (mol.L-1) |
0.20 |
0.10 |
0.050 |
0.020 |
0.010 |
0.0050 |
|
A |
0.601 |
0.302 |
0.151 |
0.060 |
0.031 |
0.016 |
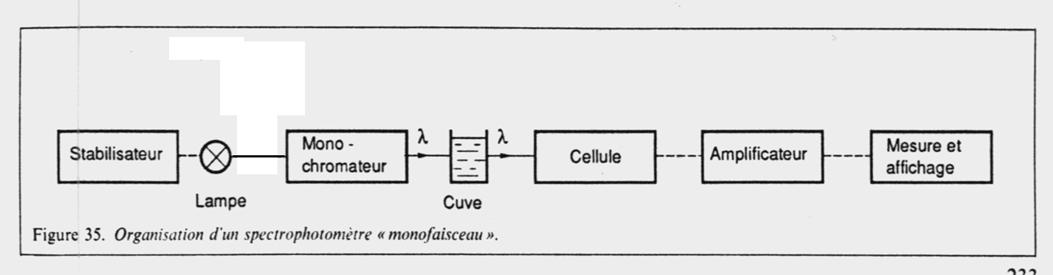
1. Faire un schéma de principe d’un spectrophotomètre UV-visible.
2. Pourquoi a-t-on choisi de travailler à cette longueur d’onde ?
3. La loi de Beer-Lambert est-elle vérifiée ?
4. Déterminer le coefficient d’absorbance linéique molaire dans ces conditions.
5. Quelle est la concentration d’une solution de sulfate de cuivre dont l’absorbance est A = 0.200.
Corrigé
1. Schéma du spectrophotomètre :
1. On a travaillé à la longueur d’onde correspondant au pic d’absorption pour que la variation du coefficient d’absorption linéique soit minimale en fonction des différentes longueurs d’onde de la lumière employée. Elle n’est, en effet, pas vraiment monochromatique. De plus, en travaillant avec des absorbances élevées, on minimise les erreurs relatives de mesures.
2. La loi de Beer-Lambert est A = e.l.c avec e et l qui sont des constantes, on doit donc obtenir une droite qui passe par 0 si on trace A = f(c).
Graphique :
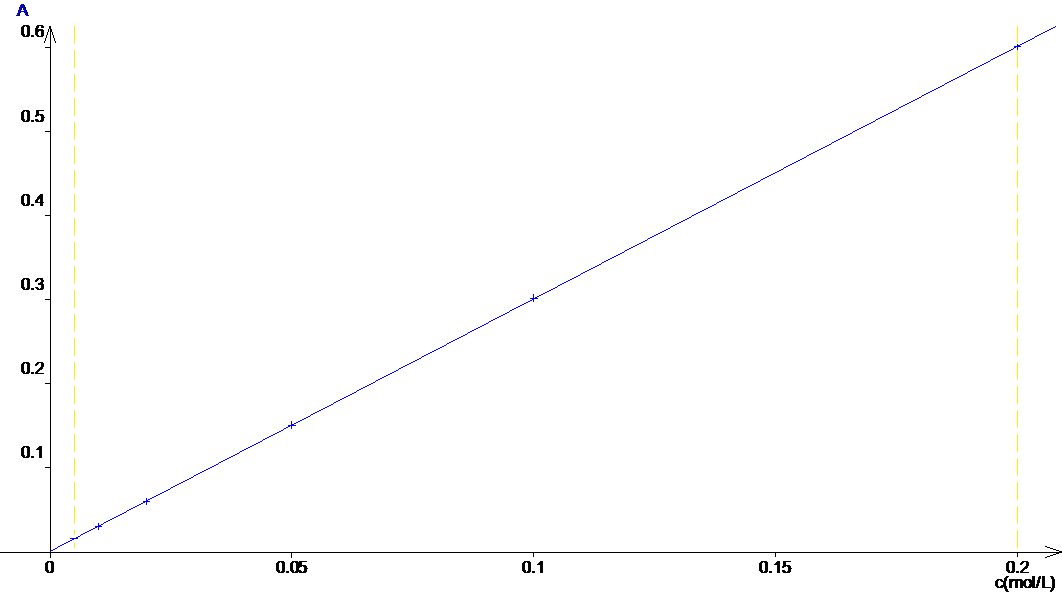
On obtient une droite qui passe par 0 : La loi de Beer-Lambert est vérifiée.
Le coefficient directeur de cette
droite est a = ![]() = 3.0 mol-1.L
= 3.0 mol-1.L
L’équation de la droite
est A = 3c.
3. On a A = e.l.c donc a
= e.l
= 3 et e
= ![]() =
= ![]() = 300 mol-1.L.m-1 soit
300 mol-1(10-3 m3).m-1
= 300 mol-1.L.m-1 soit
300 mol-1(10-3 m3).m-1
ou encore 0.30 m².mol-1(
unité du système international).
4. On
a A = e.l.c donc c = ![]() =
= ![]() = 0.067 mol.L-1 soit 67 mol.m-3.
= 0.067 mol.L-1 soit 67 mol.m-3.