Exercice n°2 BTS
Biochimiste 2003

Corrigé
1. Transmittance : T = Φt / Φi C’est le rapport du flux transmis au flux incident.
Absorbance : A = log (1/T).
2. Loi de Beer-Lambert : A = e.l.c
A est l’absorbance de la solution, e est le coefficient d’absorbance linéique molaire (m².mol-1), l est la longueur de la cuve (en m) et c la concentration de la solution (en mol.m-3).
3. On choisit la longueur d’onde qui correspond à l’absorption maximale pour la solution considérée. En effet, comme la lumière employée n’est pas parfaitement monochromatique, on travaille au maximum d’absorption pour que e puisse être considéré comme constant (Au niveau du pic d’absorption, e est quasiment identique pour le domaine très restreint de longueurs d’ondes employées.)
On travaille également à cette longueur d’onde pour avoir des valeurs d’absorbances élevées afin de minimiser les erreurs relatives de mesures.
4. Relation
entre la concentration massique et la concentration molaire : c = ![]() et 1 mol.L-1 = 103 mol.m-3
et 1 mol.L-1 = 103 mol.m-3
On peut donc compléter
le tableau :
|
r (g.L-1) |
0.60 10-3 |
1.50 10-3 |
2.40 10-3 |
3.00 10-3 |
4.50 10-3 |
6.00 10-3 |
|
A |
0.075 |
0.250 |
0.420 |
0.515 |
0.775 |
1.040 |
|
c (mol.L-1) |
1.47 10-6 |
3.67 10-6 |
5.88 10-6 |
7.35 10-6 |
1.10 10-5 |
1.47 10-5 |
|
c (mol.m-3) |
1.47.10-3 |
3.67 10-3 |
5.88 10-3 |
7.35 10-3 |
1.10 10-2 |
1.47 10-2 |
On trace A = f(c) puisque e et l sont des constantes, on devrait obtenir une droite qui passe par 0.
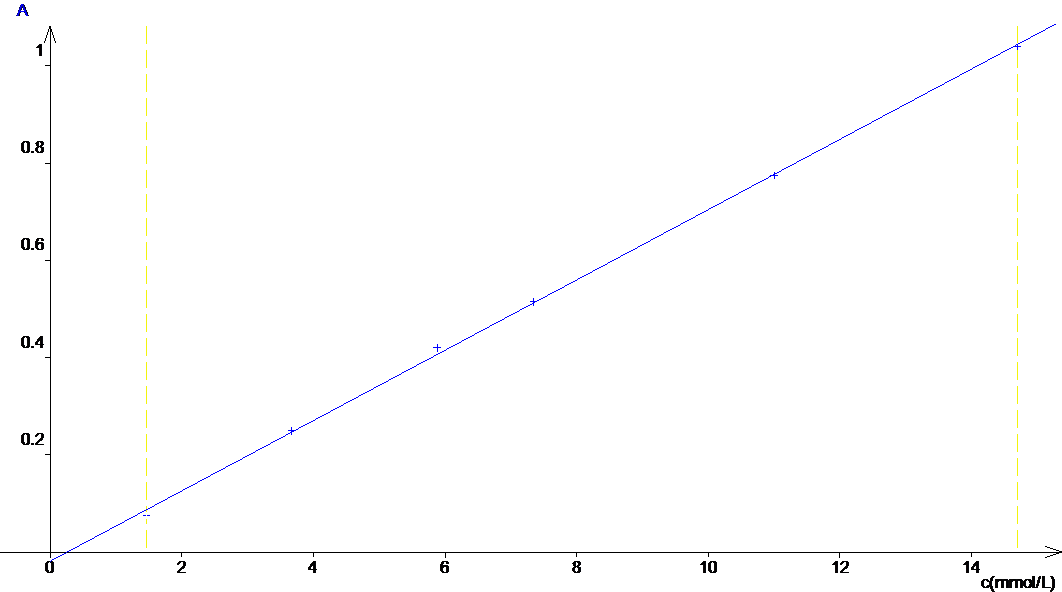
On obtient une droite qui passe par 0 : la loi de Beer-Lambert est vérifiée.
L’équation de la droite est A = 72.3.c
Remarque : La valeur de b obtenue ( b=0.02) est suffisamment proche de 0 pour qu’on admette que la droite passe par 0.
On peut également effectuer une régression linéaire à la calculatrice.
La régression linéaire donne un coefficient de corrélation r=0.999, on est bien en présence d’une droite puisque r>0.99. L’équation de la droite donnée par la calculatrice est A = 72.4.c. la valeur de « b » ( de y = ax+b) est suffisamment faible pour être assimilable à 0.
5. On a A = e.l.c et A = 72.3.c donc e.l = 72.3 soit e = ![]() =
= ![]() = 7.23 103 m².mol-1.
= 7.23 103 m².mol-1.
6. On
a A = e.l.c
donc c = ![]() =
= ![]() = 7.34 10-3
mol.m-3 soit 7.34 10-6 mol.L-1.
= 7.34 10-3
mol.m-3 soit 7.34 10-6 mol.L-1.
Puisque c = ![]() on
a r = c.M = 2.99 10-3
g.L-1.
on
a r = c.M = 2.99 10-3
g.L-1.
Cette valeur est très proche de celle obtenue pour A = 0.515, mais inférieure, ce qui parait illogique. La limite de la précision des mesures ne permet pas de donner toutes les valeurs du tableau à 3 chiffres significatifs.