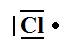Exercice n°2
On donne les quatre éléments suivants : Na (Z=11), Al (Z=13), Cl (Z=17) et Ar (Z=18).
1. Donner
leurs structures électroniques ainsi que le remplissage des cases quantiques de
leur dernière couche.
2. Qu’ont-ils tous de commun ?
3. Représenter les représentations de Lewis de
Na, Cl et Ar. En déduire le nombre de liaisons qu’ils peuvent établir.
4. Quels ions sont susceptibles de former ces
quatre éléments ? représenter leurs structures électroniques.
5. Les ions vérifient-ils la règle de l’octet ?
Corrigé
1. Na :
1s² 2s² 2p6 3s1 soit ![]()
Al : 1s² 2s² 2p6 3s23p1
soit ![]()
![]()
Cl : 1s² 2s² 2p6 3s23p5
soit ![]()
![]()
Ar : 1s² 2s² 2p6 3s23p6
soit ![]()
![]()
2. Tous ces éléments appartiennent à la troisième période : ils ont trois couches électroniques.
3. D’après les cases quantiques représentées au 1, on a :
|
Na |
1 électron célibataire. |
|
Il peut faire une liaison. |
|
Cl |
3 doublets et 1 électron célibataire. |
|
Il peut établir une liaison. |
|
Ar |
4 doublets non liants |
|
Il ne peut établir aucune liaison. |
4. Na peut former Na+ : 1s² 2s² 2p6 qui a une couche périphérique en octet.
Cl peut former Cl- : 1s² 2s² 2p6 3s23p6 qui a une couche périphérique en octet.
Ar ne forme pas d’ions : il est stable car sa couche périphérique respecte la règle de l’octet.
5. Les ions formés ci-dessus respectent la règle de l’octet, ils ont 4 doublets périphériques.