Exercice n°1 Bac STL 2006
L’eau de Javel est un
antiseptique couramment utilisé. Les solutions d’eau de javel contiennent
entres autres, des ions hypochlorite ClO- responsables des
propriétés antiseptiques de l’eau de Javel.
1) Réaction de décomposition
de l’ion hypochlorite
On donne les valeurs
des potentiels rédox suivants :
O2 / H2O E1 = 0,54 V
ClO-/Cl- E2 = 1,03 V
1.1)
Pour chacun des
couples ci-dessous, écrire la demi-équation électronique
1.2)
Montrer que l’ion
hypochlorite peut réagir avec l’eau
1.3)
Montrer que l’équation de la réaction s’écrit : ClO- = Cl- + ½ O2.
2) Etude cinétique de
la réaction de décomposition
La décomposition de
l’ion hypochlorite est lente, de sorte que la concentration de l’ion
hypochlorite dans les solutions commerciales d’eau de Javel diminue lentement
au cours du temps.
La courbe de la figure 1 représente l’évolution de la
concentration en ion hypochlorite [ClO-] pour une solution de concentration
initiale [ClO-]0 = 2 mol/L maintenue à la température q1 =
L’unité utilisée pour
l’axe des abscisses et la semaine
2.1) Donner l’expression de la vitesse v
de disparition de l’ion hypochlorite.
2.2) Calculer, à l’aide du graphique, (en
mole par litre par semaine) la valeur de cette vitesse à chacune des dates t =
0 semaine et t = 10 semaines.
2.3) Comment évolue la valeur de la
vitesse v au cours du temps ? Quel est le facteur responsable de cette
évolution ?
2.4) Le tableau ci-dessous donne les
valeurs de al vitesse v à différentes dates :
t(sem) 6,5 19,5
[ClO-] en mol/L 1 0,5
V (mol/L/sem) 0,076 0,019
a)
Quelle relation existe-t-il entre la vitesse v et la concentration en ion hypochlorite
dans le cas d’une réaction d’ordre 2.
b)
Montrer que les valeurs données dans le tableau sont en accord avec l’hypothèse
d’une réaction de décomposition de l’ion hypochlorite d’ordre deux.
3) Influence de la température
sur la décomposition de l’ion hypochlorite
Les courbes 2 et 3 de la figure 2 fournie en
annexe représente l’évolution de la concentration en ion hypochlorite dans deux
solutions d’eau de javel de même concentration initiale, maintenues à des
températures différentes q2
= 40°C et q3 = 20°C. Attribuer à chaque courbe la température correspondante en
justifiant les raisons de votre choix.
Corrigé
1. Réaction de décomposition de l’ion hypochlorite.
1.1 (1) ClO- + 2H+ + 2é = Cl- + H2O.
(2) 2 H2O = O2 + 4H+ + 4é.
1.2 La règle du gamma est applicable : la réaction entre l’ion hypochlorite et l’eau est possible.
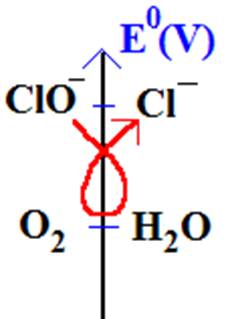
1.3 On fait la somme 2x(1) + (2) et on obtient :
2 ClO- + 2 H2O + 4H+ = O2 + 2Cl- +2 H2O + 4H+
Soit 2 ClO- = O2 + 2Cl-
Ou encore ClO- (aq) = ½ O2 (g)+ Cl-(aq)
2. Etude cinétique :
2.1 v = ![]()
2.2 On détermine pour cela
les valeurs absolues des coefficients directeurs des tangentes à la courbe [ClO-]
= f(t) aux points considérés.
·
Coefficient directeur de la tangente T0 :
a0 = ![]() =
= ![]() = -0.25 mol.L-1.semaine.
= -0.25 mol.L-1.semaine.
Donc V0 = |a0|
= 0.25 mol.L-1.semaine.
·
Coefficient directeur de la tangente T1 :
a1 = ![]() = -0.047 mol.L-1.semaine.
= -0.047 mol.L-1.semaine.
Donc V1 = |a0|
= 0.047 mol.L-1.semaine.
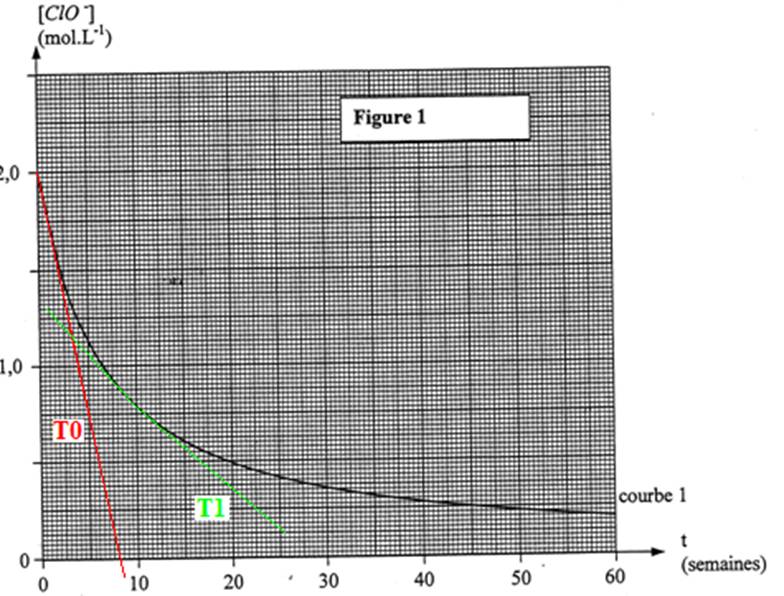
Remarque : sur ce graphique la tangente verte a été mise à titre indicatif.
2.3 On remarque que V diminue au cours du temps. Il y a de moins en moins de réactifs, donc de moins en moins de chances qu’ils puissent réagir.
2.4 Ordre 2.
a- A l’ordre 2 on peut écrire V = k [ClO-]2 .
b- Si la réaction est bien d’ordre 2, V0 = k [ClO-]02 et V1 = k [ClO-]12 ou encore
k
= 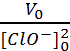 =
= 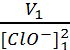
On remarque que 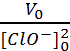 =
= 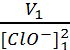 = 0.076 L.mol-1.semaine-1.
= 0.076 L.mol-1.semaine-1.
La relation est donc
bien vérifiée et l’hypothèse de l’ordre 2 est confirmée.
3. On a k = A e-Ea/RT donc si T augmente, k augmente.
La décomposition est
plus rapide si T est plus grand.
La courbe 2 représente
donc la décomposition à q = 20°C (la décomposition se fait
lentement).
La courbe 3 représente
donc la décomposition à q = 40°C (la décomposition se fait rapidement).