Exercice n°2
On dispose de deux réacteurs, de
volume 1L, contenant de un mélange gazeux de dihydrogène et de diazote qui
viennent juste d’être préparés. A l’instant t = 0, on introduit une quantité de
fer, solide, dans le réacteur n°1. Le
réacteur n°2 est laissé tel quel. On chauffe les deux réacteurs, à une
température élevée, mais identique pour les deux et on laisse la réaction se
dérouler. La température et la pression ne varient pas au cours de
l’expérience.
Toutes les cinq minutes, on mesure la
quantité de matière restante de H2 dans les deux réacteurs. La
réaction qui a lieu dans les deux réacteurs est la synthèse de l’ammoniac :
N2
(g) + 3 H2 (g) = 2 NH3 (g)
Pour cet exercice, on assimilera les
quantités de matières de gaz dans un litre à des concentrations et on traitera
l’exercice comme un exercice de chimie des solutions. On admet que l’ordre
partiel par rapport à N2 est nul.
On obtient les résultats
suivants :
|
t (min) |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
|
Réacteur n°1 [H2] mol.L-1 |
100 |
97.5 |
95 |
92.5 |
90 |
87.5 |
85 |
82.5 |
|
Réacteur n°2 [H2] mol.L-1 |
100 |
Non effectué |
Non effectué |
Non effectué |
Non effectué |
Non effectué |
Non effectué |
97 |
1.
Pour le réacteur
n°1 :
1.1
Représenter
l’évolution de [H2] en fonction du temps, sur une feuille de papier
millimétré.
1.2
Déterminer la
vitesse instantanée de disparition de H2 à t = 15 minutes
1.3
Déterminer
graphiquement l’ordre de cette réaction. (Il ne peut s’agir que d’une réaction
d’ordres 0, 1 ou 2).
1.4
Déterminer la
constante de vitesse de cette réaction chimique ainsi que le temps de
demi-réaction par la méthode de votre choix.
1.5
Donner la
relation exprimant la concentration restante de dihydrogène, C, en fonction de
la concentration initiale, C0, et du temps écoulé, t.
2.
Que peut-on dire
de l’évolution de la concentration du dihydrogène dans le flacon n°2 ?
Quel est le rôle d’un catalyseur ?
3.
Sachant que le fer est sous forme solide dans
le réacteur n°1, parle t-on de catalyse homogène ou hétérogène ? Justifier
votre réponse.
4.
Expliquer le principe
de fonctionnement du catalyseur, Fe.
5.
Quel est le rôle
du catalyseur sur l’énergie d’activation de cette réaction ?
Corrigé
1. Pour le réacteur n°1.
1.1 On obtient le graphique suivant :
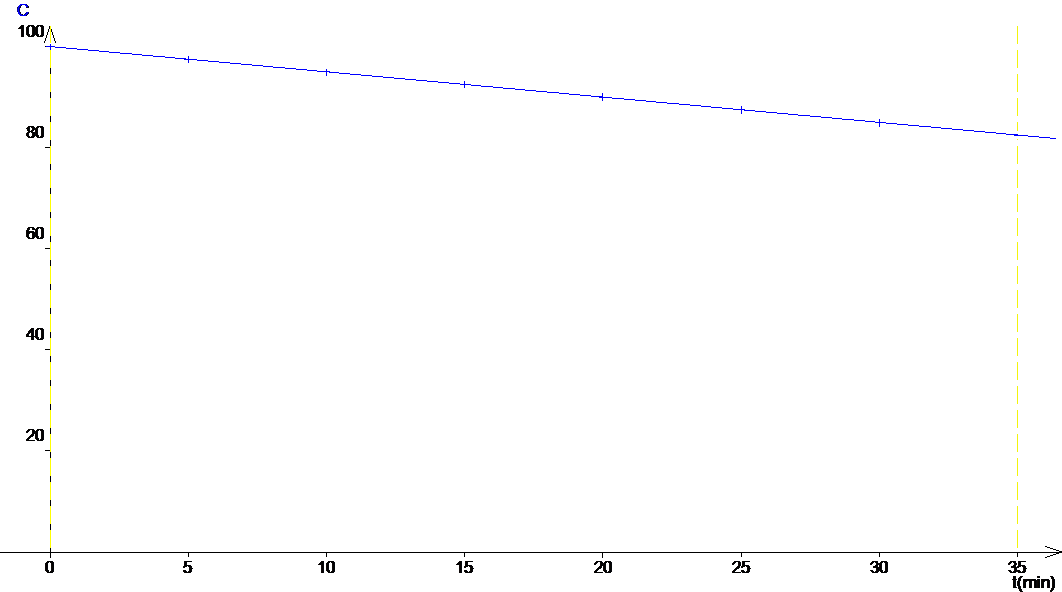
L’équation de la droite obtenue est [H2] = -0.5 t + 100
1.2 Pour déterminer la vitesse instantanée de disparition à t = 15 minutes, on trace la tangente à la courbe à cet instant. La tangente est confondue avec la courbe puisque celle-ci est une droite. Elle a donc même coefficient directeur.
Donc V15 = |a| = 0.5 mol.L-1.min-1.
1.3 Puisque la courbe C=f(t) est une droite alors il s’agit d’une réaction d’ordre 0.
1.4 La constante de vitesse correspond à la valeur absolue du coefficient directeur de la droite C = f(t) pour l’ordre 0. Donc ici k = 0.5 mol.L-1.min-1.
Le temps de demi-réaction est la durée au bout de laquelle C = C0/2 soit ici C = 50 mol.L-1.
Remarque : si C = C0/2
alors t = T donc C = C0 – kt s’écrit C0/2 = C0
–kT et T = ![]()
On en déduit T = 100
minutes.
1.5 On a C = 100 – 0.5t.
2. L’évolution est très faible dans l’autre flacon. On en déduit qu’un catalyseur accélère une réaction chimique.
3. Il s’agit d’une catalyse hétérogène, les réactifs et le catalyseur ne sont pas dans les mêmes états physiques (solide et gaz).
4. Les molécules de gaz s’adsorbent (se fixent) sur le catalyseur, leurs liaisons intramoléculaires s’affaiblissent car les atomes se lient au fer. Les liaisons étant affaiblies elles peuvent se briser plus facilement, ces molécules sont donc plus réactives.
5. Le catalyseur abaisse l’énergie d’activation de la réaction.