Exercice n°3 Bac Stl BGB 2005
E° (02 / H202
) = 0,68 V
E° (H202
/ H20 ) = 1,77 V
Les lentilles de
contact souples doivent être retirées quotidiennement.
Sur la notice d’un
système commercial d’entretien on peut lire :
Le système commercial
X permet de réaliser la décontamination des lentilles et l’élimination de la
solution désinfectante selon le processus suivant :
-
la solution de
peroxyde d’hydrogène (ou eau oxygénée) décontamine les lentilles en éliminant
les germes pathogènes
-
un disque
catalytique recouvert de platine situé à l’extrémité du porte lentilles permet
d’éliminer le peroxyde d’hydrogène en le transformant en eau et en dioxygène.
-
Après 6 heures de
traitement, les lentilles de contact peuvent être posées directement sur les
yeux.
1)
Ecrire les
demi-équations électroniques des couples mises en jeu dans la décomposition du
peroxyde d’hydrogène, puis l’équation de la réaction.
2)
Le platine est un
catalyseur pour la décomposition du peroxyde d’hydrogène
2.1)
Donner le définition d’un catalyseur
2.2)
Pourquoi qualifie t-on d’hétérogène la catalyse par le platine ?
2.3)
Pourquoi faut il quelques heures de traitement avant de poser les lentilles sur
les yeux
3)
L’étude cinétique
de la transformation est menée à température ambiante.
A l’instant t = 0, le disque de platine
est introduit dans un volume Vs = 50 mL de la solution de peroxyde d’hydrogène.
On détermine à chaque instant le volume de dioxygène dégagé et on en déduit la
concentration molaire en peroxyde d’hydrogène restant. Les résultats sont les
suivants :
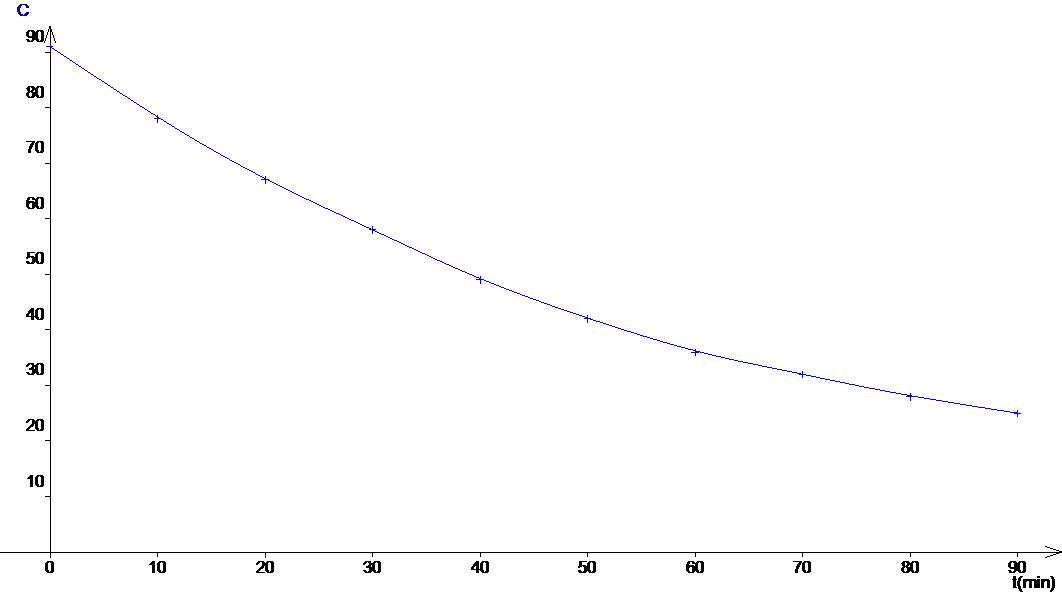
|
t (min) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|
[H2O2]
mmol.L-1 |
91 |
78 |
67 |
58 |
49 |
42 |
36 |
32 |
28 |
25 |
3.1) tracer la courbe [H2O2] =
f(t).
3.2)
Déterminer graphiquement la valeur de la disparition de l’eau oxygénée à t = 0
min.
3.3) Définir puis déterminer
graphiquement le temps de demi-réaction.
3.4) Indiquer la méthode à suivre pour
montrer que la réaction de décomposition est d’ordre 1 par rapport au peroxyde
d’hydrogène.
Corrigé
1. Réaction rédox :
Demi-équations électroniques :
H2O2 + 2H+ + 2é = 2 H2O
H2O2 = O2 + 2H+ + 2é
On obtient le gamma suivant (1) + (2) : 2 H2O2 = 2H2O + O2
2. Catalyse.
2.1 Un catalyseur accélère une réaction chimique et n’entre pas dans le bilan de la réaction (équation de réaction). Il est régénéré en fin de réaction.
2.2 Le platine est un solide alors que le reste des réactifs est sous forme liquide. Catalyseur et réactifs ne sont pas dans le même état physique : la catalyse est hétérogène.
2.3 La décomposition du peroxyde d’hydrogène est une réaction lente. Même catalysée, il faut attendre suffisamment pour que la concentration en H2O2 soit suffisamment faible pour que les lentilles puissent être mises sur les yeux.
3. Etude cinétique. On note C la concentration de H2O2.
3.1 On obtient le graphe suivant :
3.2 La valeur de la vitesse instantanée à t=0 correspond à la valeur absolue du coefficient directeur de la tangente à la courbe C = f(t) à cet instant.
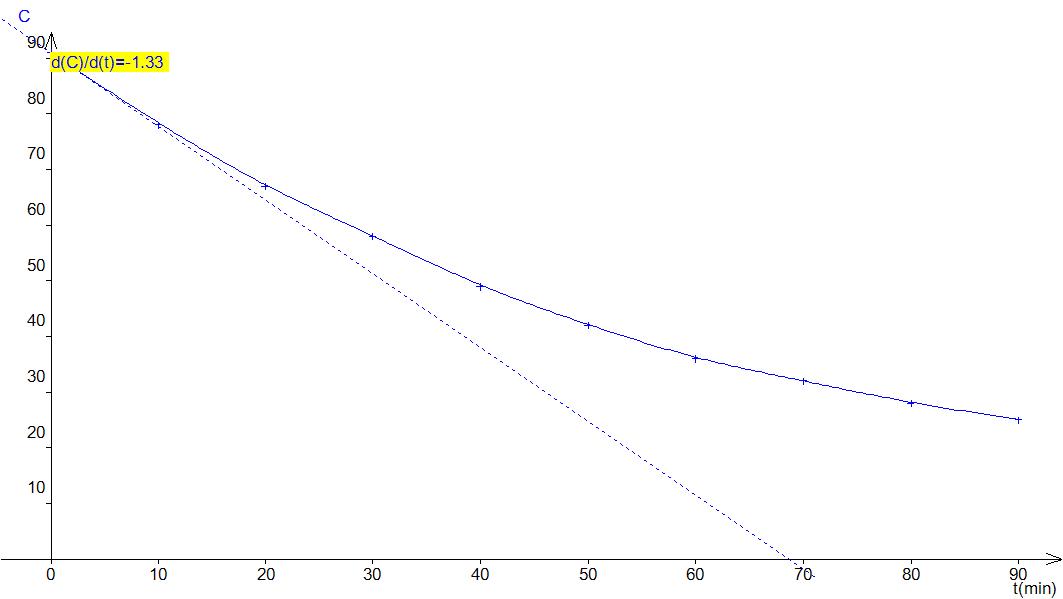
Le coefficient directeur de la
tangente est a = ![]() = -1.33 mol.L-1.min-1.
= -1.33 mol.L-1.min-1.
On en déduit que V0
= |a| = 1.33 mol.L-1.min-1.
3.3 Le temps de
demi-réaction, t1/2 est la durée au bout de laquelle la
concentration initiale a été divisée par deux. On peut la lire directement sur
le graphique.
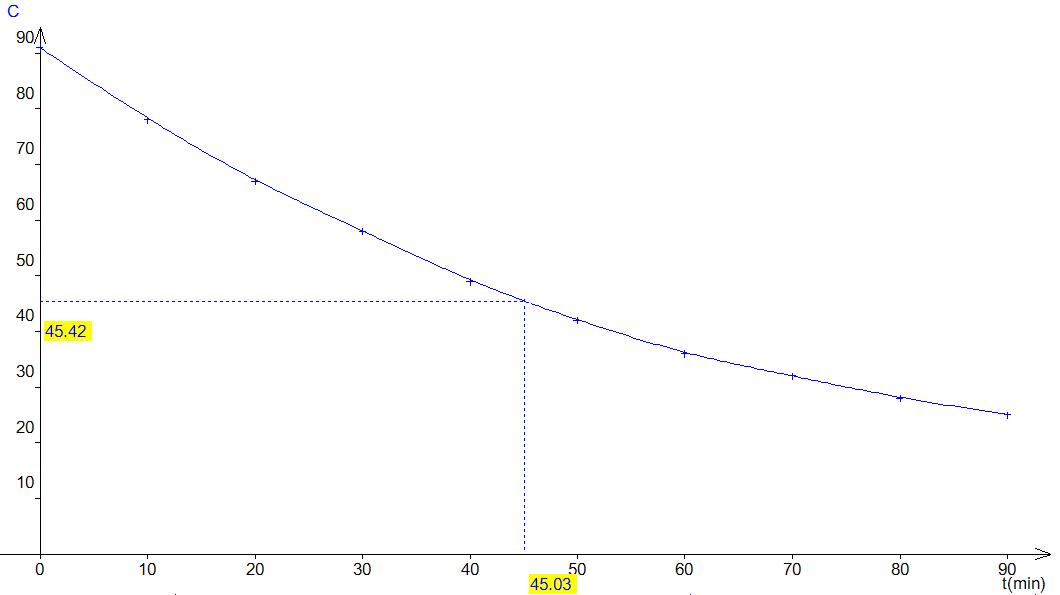
Soit t1/2 =
45 minutes.
3.4 Il faut tracer ln (C)
= f(t). Si on obtient une droite, cela signifie que la réaction est d’ordre 1.