Exercice n°4
On étudie la
saponification du méthanoate d’éthyle qui produit de l’éthanol et l’ion
méthanoate.
1- A t =0, on dispose
de 0,01 mol/L de soude et d’ester. On suit l’évolution de la réaction au cours
du temps et on note les résultats suivants à 25°C:
|
t en s |
0 |
180 |
240 |
300 |
360 |
|
[alcool] en mmol/L |
0 |
2.6 |
3.17 |
3.66 |
4.11 |
a)
Montrer que la
réaction est d’ordre global 2.
b)
En déduire dans
l’hypothèse la plus simple, les ordres partiels par rapport à chacun des
réactifs.
2-Calculer en
précisant les unités, la constante de vitesse à
Corrigé
1. Afin de montrer que cette réaction est d’ordre 2, on doit d’abord déterminer les concentrations des réactifs.
a- On a : Dans V = 1L
|
|
CH3COOC2H5 |
+ OH- |
= CH3COO- |
+ C2H5OH |
|
EI |
0.01 |
0.01 |
0 |
0 |
|
E(t) |
0.01 -x |
0.01-x |
x |
x |
On remarque qu’à tout instant on a C = [CH3COOC2H5] = [OH-]
Comme x est donné dans le tableau ci-dessus, on peut déterminer 0.01-x en fonction du temps.
On peut également calculer 1/C en fonction du temps.
|
t en s |
0 |
180 |
240 |
300 |
360 |
|
[alcool] en mmol/L |
0 |
2.6 |
3.17 |
3.66 |
4.11 |
|
[CH3COOC2H5]
en mol/L |
0.01 |
0.0074 |
0.00683 |
0.00634 |
0.00589 |
|
1/C |
100 |
135.1 |
146.4 |
157.7 |
169.8 |
Afin de montrer que la réaction est d’ordre 2 on trace 1/C = f(t).
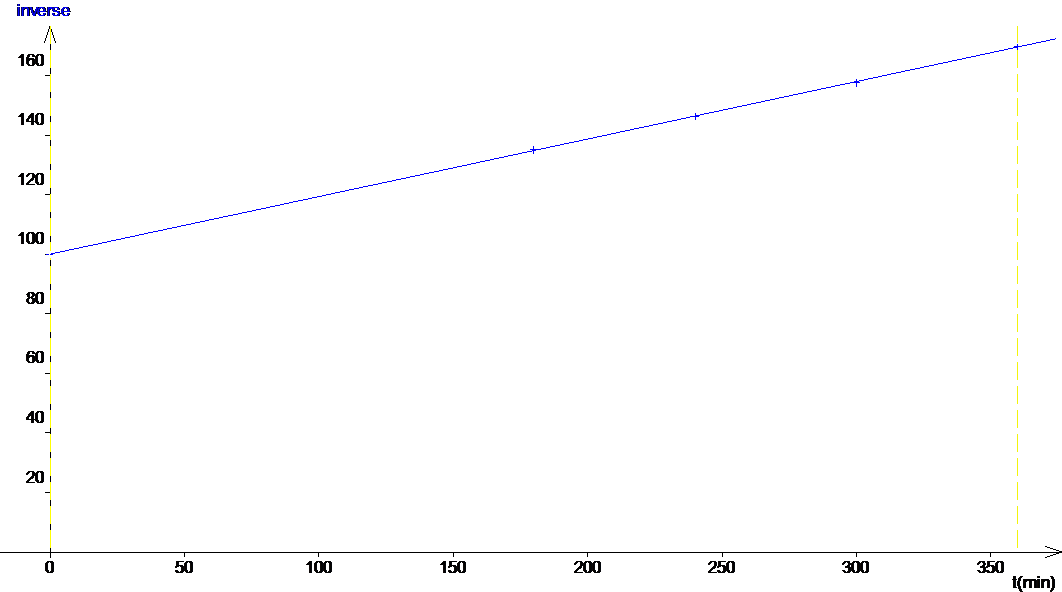
1/C en fonction du temps est une droite : la réaction est d’ordre 2.
L’équation de cette droite est 1/C = 0.193t + 100
b- l’hypothèse la plus probable est que les deux ordres partiels soient égaux à 1, et donc l’ordre global est égal à 2.
V = k [CH3COOC2H5]1[OH-]1
Or on a [CH3COOC2H5] = [OH-] à tout instant donc on peut écrire :
v = k [CH3COOC2H5]2 = k [OH-]2
Il s’agit bien d’une réaction d’ordre global 2 et dont les ordres partiels sont égaux à 1.
2. La constante de vitesse correspond au coefficient directeur de la droite tracée ci-dessus.
On obtient k = 0.193 mol-1.L.min-1.
Pour déterminer T1/2 à
l’ordre 2 on emploie la formule T1/2 = ![]() =
= ![]() = 518 minutes.
= 518 minutes.
Ce résultat est cohérent avec les valeurs de C obtenues dans le tableau ci-dessus.