Exercice n°6
On veut étudier la cinétique de la réaction de saponification de l’acétate d’éthyle par la soude.
CH3COOC2H5 + OH- = CH3COO- + C2H5OH
A t=0 le mélange réactionnel a un volume de 1 litre et contient nester = 5.10-2 mol et nsoude = 5.10-2 mol.
Toutes les 4 minutes, on prélève 5 mL de mélange, on le dilue afin d’arrêter la réaction et on le dose par de l’acide chlorhydrique de concentration 1.00 10-2 mol.L-1 pour déterminer la concentration restante d’ions OH-.
On obtient le tableau suivant :
|
t(min) |
0 |
4 |
8 |
12 |
16 |
20 |
24 |
28 |
32 |
36 |
40 |
44 |
|
VHCl
(mL) |
25 |
22 |
19.8 |
18 |
16.5 |
15 |
13.8 |
12.8 |
12 |
11.5 |
11 |
10.5 |
1. Calculer la concentration d’ester contenue
dans chaque prélèvement.
2. Calculer la vitesse moyenne de disparition de
l’ester entre les instants t1 = 4 min et t2 = 8 min, puis
entre les instants t3 = 24 min et t4 = 28 min.
Comment
varie la vitesse moyenne de réaction ? Interpréter cette variation.
3. Représenter graphiquement l’évolution de la
concentration d’ester en fonction du temps.
4. Déterminer la vitesse instantanée initiale V0
et la vitesse instantanée à t=12 min, V12.
Corrigé
1. Réaction simplifiée et tableau
d’avancement :
|
|
CH3CO2C2H5 |
+ OH- |
= |
CH3CO2- |
+ C2H5OH |
|
Etat initial |
5.10-2 |
5.10-2 |
|
0 |
0 |
|
Etat intermédiaire |
5.10-2-x |
5.10-2-x |
|
x |
x |
L’état
intermédiaire correspond à l’état à l’instant t. x est une fonction de t.
On peut
remarquer que d’après le tableau d’avancement, à tout instant, nCH3CO2C2H5 = n OH- donc CCH3CO2C2H5 = C OH-.
On peut
déterminer la concentration restante de soude, donc C OH-, à l’aide
du dosage :
H3O+ + OH- =
2 H2O
Ce qui
amène à C OH- =. CHCl VHCl / VOH-.
On peut donc déterminer à chaque instant la concentration de soude restante et
donc la concentration d’ester à chaque instant en appliquant cette formule.
Cester
= C OH- = ![]() en exprimant VHCl en mL.
en exprimant VHCl en mL.
1.
|
t (min) |
V HCl (mL) |
C ester (mol/L) |
|
0 |
25 |
0,05 |
|
4 |
22 |
0,044 |
|
8 |
19,8 |
0,0396 |
|
12 |
18 |
0,036 |
|
16 |
16,5 |
0,033 |
|
20 |
15 |
0,03 |
|
24 |
13,8 |
0,0276 |
|
28 |
12,8 |
0,0256 |
|
32 |
12 |
0,024 |
|
36 |
11,5 |
0,023 |
|
40 |
11 |
0,022 |
|
42 |
10,5 |
0,021 |
2. Vmoy1 = 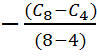 = 1.1
10-3 mol.L-1.min-1.
= 1.1
10-3 mol.L-1.min-1.
Vmoy2 = 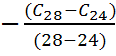 = 5 10-4
mol.L-1.min-1.
= 5 10-4
mol.L-1.min-1.
On a mis un signe negatif devant
les formules puisqu’il s’agit de vitesses de disparitions et qu’une vitesse est
toujours positive.
3. Evolution de l’ester en fonction du
temps :
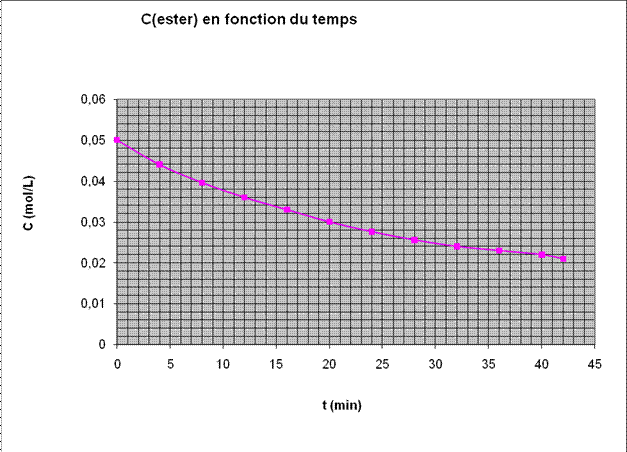
4. La
vitesse instantanée de disparition de l’ester initiale correspond à l’opposé du
coefficient directeur de la tangente à l’origine T0.
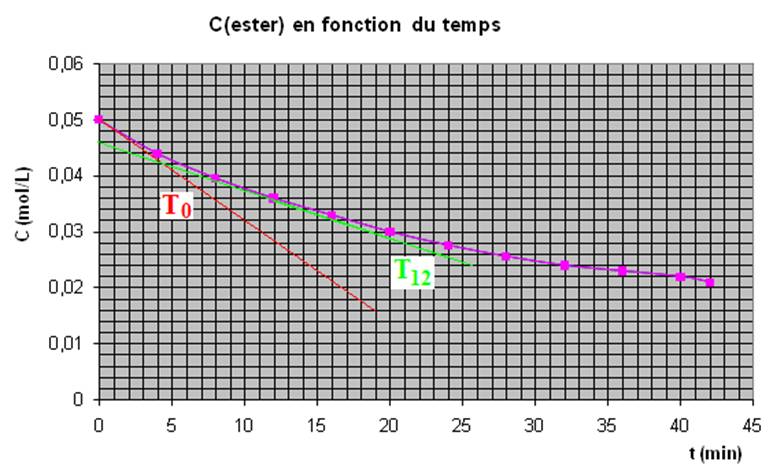
a= (Yb-Ya) / (Xb-Xa)
= (0-0.05)/ (32-0) =-1.5 10-3
donc V0 = 1.5 10-3 mol.L-1.min-1.
La
vitesse instantanée de disparition de l’ester à t = 12 min correspond à
l’opposé du coefficient directeur de la tangente à la courbe lorsque t = 12 min
(droite T12).
a'= (Yb-Ya) / (Xb-Xa)
= (0.008-0.026)/(46-24)= -8 10-4 donc V’ = 8 10-4 mol.L-1.min-1.