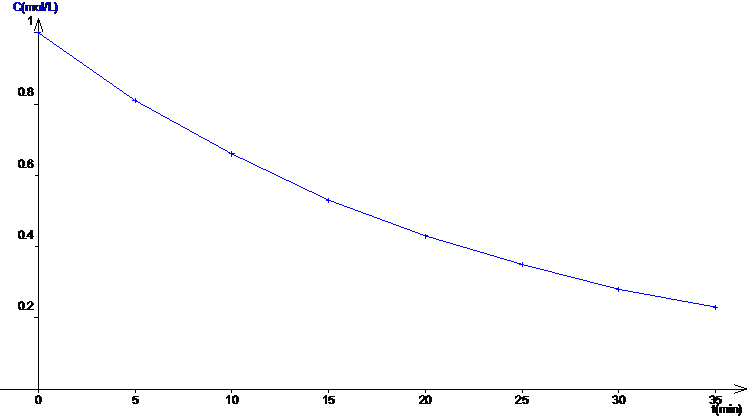
Exercice n°7
On dispose de deux flacons contenant
de l’eau oxygénée de concentration 1 mol.L-1 qui viennent juste
d’être préparés. A l’instant t = 0, on introduit, sans variation de volume
notable, une quantité de chlorure de fer III dans le flacon n°1. Le flacon n°2
est laissé tel quel.
Toutes les cinq minutes, on dose la
quantité restante de H2O2 dans les deux flacons. La
réaction qui a lieu dans les deux flacons est la décomposition de l’eau
oxygénée :
2 H2O2 = O2
+ 2 H2O.
On obtient les résultats
suivants :
|
t (min) |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
|
Flacon n°1 [H2O2] mol.L-1 |
1.0 |
0.81 |
0.66 |
0.53 |
0.43 |
0.35 |
0.28 |
0.23 |
|
Flacon n°2 [H2O2] mol.L-1 |
1.0 |
Non effectué |
Non effectué |
Non effectué |
Non effectué |
Non effectué |
Non effectué |
0.99 |
Pour le flacon n°1 :
1.
Représenter
l’évolution de [H2O2] en fonction du temps, sur une
feuille de papier millimétré. Echelle :
2.
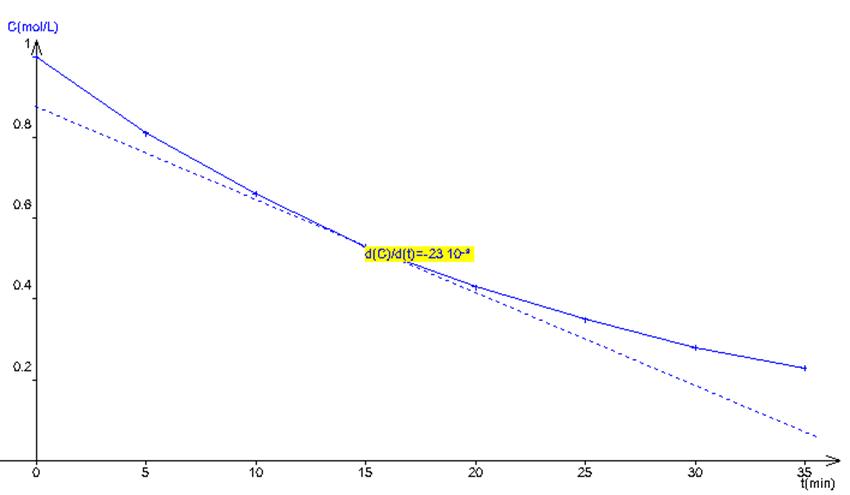
Calculer la
vitesse de disparition moyenne de l’eau oxygénée entre les instants t = 5 minutes et t = 25 minutes.
3.
Déterminer la
vitesse instantanée de disparition de l’eau oxygénée à t = 15 minutes.
4.
En déduire la
vitesse de réaction à cet instant.
5.
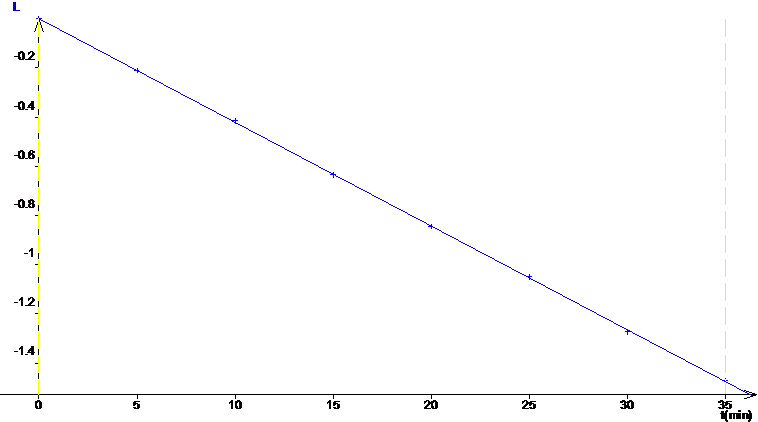
Déterminer
graphiquement l’ordre de cette réaction. (Il ne peut s’agir que d’une réaction d’ordres
0, 1 ou 2). Le ou les graphes seront réalisés sous le graphe de la question 1.1
avec des échelles convenables (éventuellement sous le graphe de physique, en
cas de manque de place).
6.
Déterminer la
constante de vitesse de cette réaction chimique ainsi que le temps de
demi-réaction par la méthode de votre choix.
7.
Donner la
relation exprimant la concentration restante d’eau oxygénée, C, en fonction de
la concentration initiale, C0, et du temps écoulé, t.
8.
Que peut-on dire
de l’évolution de la concentration de l’eau oxygénée dans le flacon n°2 ?
Quel est le rôle d’un catalyseur ?
9.
Sachant que le
chlorure de fer est en solution dans le flacon n°1, parle t-on de catalyse
homogène ou hétérogène ? Justifier votre réponse.
Corrigé
|
1 |
C = f(t)
C = [H2O2]. t est exprimé en minutes. |
|
2 |
Vm = - (C25 – C5)
/ 20 = - (0.35 – 0.81) / 20 = 0.023 mol.L-1.min-1. |
|
3 |
Le coefficient directeur de la tangente à la
courbe pour t = 15 minutes est a= - 0.023. On peut en conclure, qu’à cet instant, la
vitesse de disparition instantanée de H2O2 est V15 =
|a| = 0.023 mol.L-1.min-1. |
|
4 |
Vréaction = On a divisé par 2 car le coefficient stœchiométrique
de H2O2 est 2. |
|
5 |
On trace Ln [H2O2] =
f(t). Sur le graphique on a posé L = Ln [H2O2].
On obtient une droite de coefficient
directeur a’ = -0.042 Il
s’agit donc d’une réaction d’ordre 1. Remarque : La tracé de 1/C = f(t) ne
donne pas une droite, ce qui exclue l’ordre 2, et C=f(t) n’étant pas une
droite, l’ordre 0 est également exclu. |
|
6 |
D’après la question précédente, on a k = |a |=
0.042 min-1. Et τ = ln (2) / k = 16.5 minutes. Remarque :
on peut déterminer τ graphiquement sur la courbe C = f(t) puis
calculer k. |
|
7 |
Puisqu’il s’agit d’une réaction d’ordre
1 : C = C0 e-kt |
|
8 |
On
peut dire que la concentration d’eau oxygénée n’a pratiquement pas variée.
Elle a diminué de façon minime. Le
rôle d’un catalyseur est d’accélérer une réaction chimique. |
|
9 |
On parle de catalyse homogène puisque le
catalyseur est dans le même état physique que les réactifs. |