Exercice n°8 type BTS.
On donne la réaction redox concernant les ions
persulfates et iodures suivante :
S2O82- +
2 I- = 2
SO42- + I2
Dans un premier temps, on introduit dans le
mélange réactionnel, un très large excès d’ions iodures, de sorte que l’on
puisse faire l’approximation que la concentration en ions iodures reste
constante au cours du temps.
On a pour la première expérience les données
suivantes :
Θ1 = 25.5 °C ; [S2O82-]0
= 0.010 mol.L-1 et [ I-]0 = 1.0 mol.L-1.
On mesure la concentration restante d’ions
persulfate dans le mélange réactionnel à différents instants et on obtient le
résultat suivant :
|
t(s) |
[S2O82-] mol.L-1 |
|
0 |
0,01 |
|
10 |
0,00943 |
|
20 |
0,00889 |
|
50 |
0,00745 |
|
75 |
0,00642 |
|
100 |
0,00554 |
|
150 |
0,00413 |
|
200 |
0,00307 |
1. Déterminer
la vitesse instantanée de disparition du persulfate à t = 100 s.
2. Déterminer,
par la méthode de votre choix, l’ordre partiel de réaction par rapport au
persulfate. Expliquez votre démarche.
On a déterminé par ailleurs que cette réaction
était du premier ordre par rapport à l’ion iodure.
3. Proposer
une méthode expérimentale ayant permis de déterminer cet ordre partiel de
réaction.
4. Donner
la relation indiquant la vitesse de réaction en fonction des concentrations en
ions iodures et persulfate ainsi que de la constante de vitesse k1.
Quel est l’ordre global de cette réaction ?
5. Dans
les conditions expérimentales indiquées ci-dessus, et en considérant que la
concentration en ions iodures ne varie pas au cours de l’expérience, déterminer
la constante de vitesse k1.
6. Dans
les mêmes conditions, établir la loi d’évolution de la concentration de
persulfate au cours du temps : [S2O82-] =
f (t).
7. Cette
expérience a été réalisée à une température différente, et on a pu calculer une
nouvelle constante de vitesse associée à cette température : θ2
= 34°C, k2 = 0.0108 USI. A l’aide de la loi d’Arrhenius, déterminer
la valeur de l’énergie d’activation de cette réaction chimique.
Donnée : R = 8.31 J.mol-1.K-1.
Corrigé
|
1 |
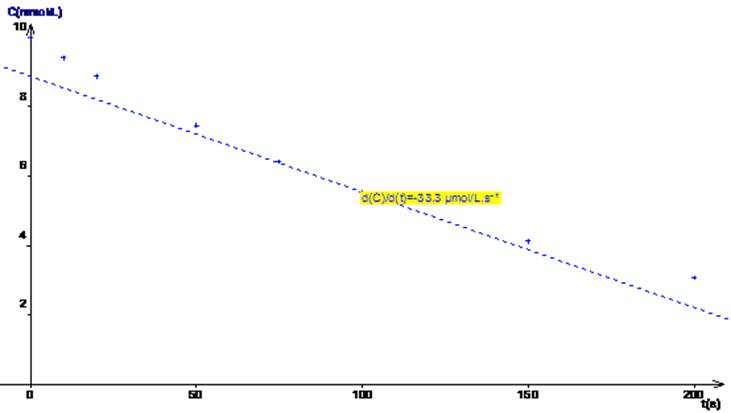
Le
coefficient directeur de la tangente à la courbe c=f(t) à t = 100 s est a=
-33.3 10-6 mol.L-1s-1. C représente [S2O82-]. Donc
la vitesse instantanée de disparition des ions persulfate est VD
= 33.3 10-6 mol.L-1.s-1. |
|
2 |
On
peut procéder par régression linéaire à l’aide de la calculatrice ou tracer
la courbe. On
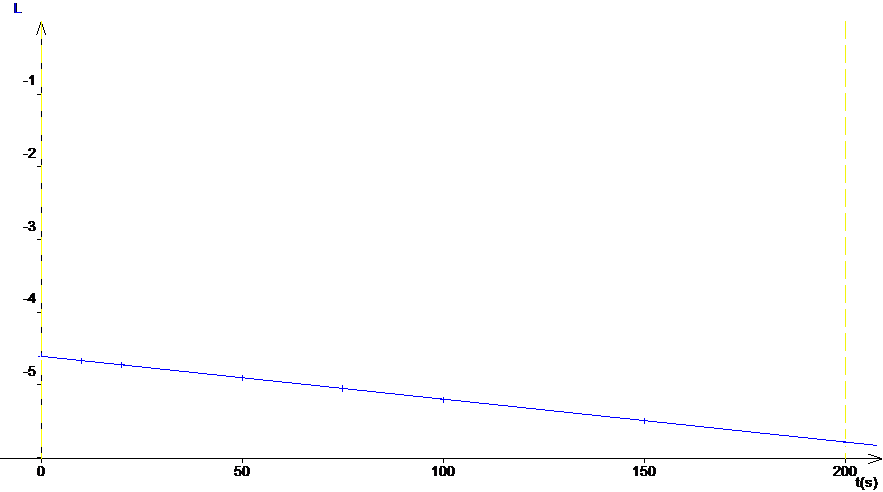
obtient une droite pour la courbe Ln (c) = f (t).
L’équation
de la droite est Ln(c) = -5.9.10-3 t – 4.605. On
obtient une droite pour le tracé de Ln(c) = f (t) (et seulement pour ce tracé,
c=f(t) et 1/c = f(t) ne sont pas des droites) on peut donc en déduire que la
réaction est d’ordre 1 par rapport à ce réactif. |
|
3 |
On
a pu procéder de la même manière que précédemment : On
a mis un large excès de persulfate, de manière à ce qu’on puisse considérer
que sa concentration reste constante au cours du temps. On peut déduire la
quantité restante d’ions iodures à chaque instant en connaissant la quantité
produite de I2 à chaque instant. Cette dernière peut être
déterminée par photométrie, I2 étant une espèce colorée qui
absorbe la lumière visible. Disposant
de l’évolution de la concentration de l’ion iodure en fonction du temps, on
peut vérifier que la réaction est d’ordre 1 par rapport à ce réactif en
traçant Ln
([I-]) = f(t). |
|
4 |
VR
= k1 [S2O82-]1. [ I-]1
la réaction est globalement
d’ordre 2 puisque l’ordre de réaction correspond à la somme des ordres
partiels. |
|
5 |
On
a [ I-] = [ I-]0
= constante. Donc VR
= k’ [S2O82-]. avec k’ = k1 [ I-]0. k’
correspond à la constante de vitesse d’une réaction d’ordre 1 ne concernant
que l’ion persulfate. k’ correspond donc à la valeur absolue du coefficient
directeur de la droite Ln(C) = f(t). Soit k’ = 5.9 10-3 s-1. Et
k1 = k’/[I]0 = 5.9 10-3 L.mol-1.s-1.
k1=k’ puisque [I]0 = 1 mol.L-1. |
|
6 |
Dans
ces conditions, on peut traiter la réaction comme une réaction d’ordre 1 ne
dépendant que d’un seul réactif : On
a VR = k’ c et VR = - dc/dt. donc
on a k’ c = -dc/dt soit dc/c = -k’ dt et ∫ dc/c =
-k’ ∫ dt Donc
[lnc] = -k’ [t] soit Lnc = - k’ t + « constante » Comme
à t=0 c=c0 on en déduit que « constante » = Lnc0. lnc
– lnc0 = -k’ t ou encore ln c/c0 = -k’ t. Soit
c= c0 e-k1t c0
étant la concentration initiale. Avec
les valeurs numériques : c = 0.010 e- 0.0059t. |
|
7 |
Loi
d’Arrhenius : k = A e- Ea/RT et T = θ + 273.15 soit T1
=299 K et T2 = 307 K. Donc
Ln k = LnA – Ea/RT Et
Ln k1 – Ln k2
= Ea/RT1
+ Ea /RT2 = Ea (-1/RT1 + 1/RT2) Soit
Ea = (Ln k1 – Ln k2)/ (1/RT1 + 1/RT2)
= 58 kJ.mol-1. |