Exercice n°1
On
mélange 500 mL d’ammoniaque à 0.10 mol.L-1
et 100 mL de sulfate de cuivre à 1.0 10-2
mol.L-1.
On
donne KD(Cu(NH3)42+)
= 2.5 10-13.
1. Ecrire la réaction de formation du complexe ainsi que son tableau
d’avancement.
2. Calculer la constante de formation de ce complexe. Que peut-on en
déduire au sujet de la réaction de formation ?
3. Déterminer les concentrations de toutes les espèces chimiques
intervenant dans la réaction de complexation en état final.
Corrigé
1. Tableau d’avancement : dans Vt = 0.60 L
|
|
Cu2+ |
+ 4 NH3 |
= Cu(NH3)42+ |
|
EI |
n0 |
n1 |
0 |
|
EF |
n0 - x |
n1- 4x |
x |
On a n0 = c0.v0 = 1.0 10-3 mol
Et n1 = c1.v1. = 5.0 10-2 mol
2. On a Kf = 1/KD = 4 1012. On peut en conclure que la réaction est totale.
3. Puisque la réaction est totale, on détermine le réactif limitant.
Hypothèse n°1 : Le réactif limitant est Cu2+.
Dans ce cas n0 – x = 0 et n0 = x = 1.0 10-3mol.
Donc en état final nNH3 = n1-4x = 0.046 mol.
Cette hypothèse est possible donc c’est elle qui est retenue (l’autre hypothèse aboutit sur une quantité finale de Cu2+ négative, donc impossible).
Concentrations en état final :
[NH3]EF = ![]() = 7.7 10-2 mol.L-1.
= 7.7 10-2 mol.L-1.
[Cu(NH3)42+]EF
= ![]() = 1.7 10-3 mol.L-1.
= 1.7 10-3 mol.L-1.
Pour déterminer [Cu2+]EF on emploie KD. soit :
KD = 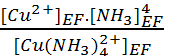 soit [Cu2+]EF
=
soit [Cu2+]EF
= 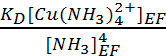 = 1.2 10-11 mol.L-1.
= 1.2 10-11 mol.L-1.