Exercice n°2 Bac STL BGB 2004

Corrigé
1. Solubilité.
1.1 Tableau d’avancement : La réaction est totale le réactif qui n’est pas en excès est donc limitant.
|
|
Ag+ |
+ Cl- |
= AgCl |
|
EI |
n0 |
Excès |
0 |
|
EF |
n0 – x = 0 |
Excès |
x |
On a n0 = c0.v0 = 1.5 10-3 mol
Et n0 = x d’après le tableau d’avancement. Soit nAgCl = 1.5 10-3mol
Donc mAgCl = nAgCl.MAgCl = 0.22 g
1.2 C’est la quantité de matière maximale d’un composé que l’on peut dissoudre dans un litre d’un solvant donné. On atteint alors la saturation.
1.3
a- Ks = [Ag+]EF.[Cl-]EF .
b- On a : Dans V = 1L d’eau pure.
|
|
AgCl |
= Ag+ |
+ Cl- |
|
EI |
n0 |
0 |
0 |
|
EF (saturation) |
n0 – s |
s |
s |
Donc
Ks = s² et s = ![]() = 1.25 10-5 mol.L-1.
= 1.25 10-5 mol.L-1.
Soit pour la solubilité en g.L-1 sm = s.MAgCl = 1.8 10-3g.L-1.
2. Complexation.
2.1 Un ligand est un ion ou une molécule lié à l’ion ou atome central du complexe. Ici le ligand est l’ammoniac, NH3.
2.2 On a : Ag+ + 2 NH3 = Ag(NH3)2+ .
2.3 Kf = 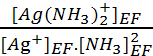
2.4 On a : Kf = 1.67 107 donc la réaction peut être considérée comme totale. Vt = 0.020 L
|
|
Ag+ |
+ 2 NH3 |
= Ag(NH3)2+ |
|
EI |
n0 |
n1 |
0 |
|
EF |
n0 - x |
n1- 2x |
x |
On a n0 = c0.v0 = 1.5 10-3 mol
Et n1 = c1.v1. = 1.0 10-2 mol
Détermination de x :
Hypothèse : Ag+ est le réactif limitant : n0-x = 0 donc x = n0 = 1.5 10-3 mol
Soit nNH3 EF = n1-2x = 7.0 10-3mol.
Le résultat est possible donc cette hypothèse est validée.
Concentrations en état final :
[NH3]EF
= ![]() = 0.35 mol.L-1.
= 0.35 mol.L-1.
[Ag(NH3)2+]EF
= ![]() = 0.075 mol.L-1.
= 0.075 mol.L-1.
Pour déterminer [Ag+]EF
on emploie Kf. soit : Kf = 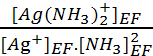 soit [Ag+]EF =
soit [Ag+]EF = 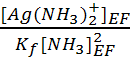 = 3.7 10-8 mol.L-1.
= 3.7 10-8 mol.L-1.
[Ag+]EF est bien proche de 0, la réaction peut être considérée comme totale.