Exercice n°3 Bac STL BGB 2006 (septembre)

Corrigé
1. la pile Daniel:
1.1 Schéma :
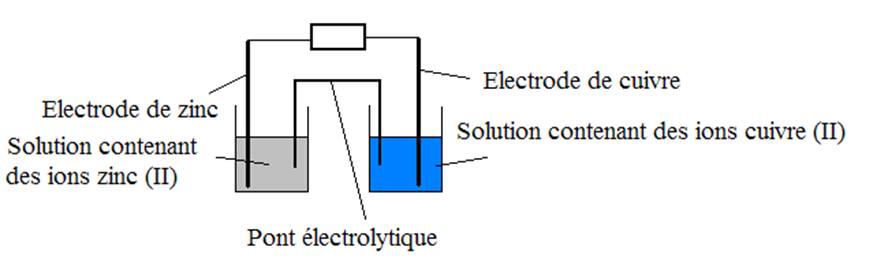
1.2 On a Cu2+ + 2é = Cu et Zn2+ + 2é = Zn.
1.3 E1 = E0Cu2+/Cu
+ ![]() Log [Cu2+] et E2 = E0Zn2+/Zn
+
Log [Cu2+] et E2 = E0Zn2+/Zn
+ ![]() Log [Zn2+]
Log [Zn2+]
1.4 E1 = 0.34 + 0.03 x Log 0.1 = 0.31 V
E2 = -0.76 + 0.03 x Log 0.1 = -0.79 V.
1.5 E =E+-E- = E1-E2 = 1.10 V (remarque comme E1>E2 c’est la demi-pile 1, donc l’électrode de cuivre qui est la borne positive).
1.6 Au pôle négatif il y a production d’électrons : Zn = Zn2+ + 2é. C’est une oxydation, cette électrode est l’anode.
Au pôle positif il y a consommation d’électrons : Cu2+ + 2é = Cu. C’est une réduction, cette électrode est la cathode.
2. Complexation :
2.1 Cu2++ 4 NH3 = Cu(NH3)42+
2.2 Kf = 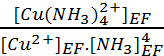 .
.
2.3 On a le tableau d’avancement suivant : Vt = 0.10 L
|
|
Cu2+ |
+ 4 NH3 |
= Cu(NH3)42+ |
|
EI |
n0 |
n1 |
0 |
|
EF |
n0 - x |
n1- 4x |
x |
On a n0 = c0.v0 = 1.0 10-2 mol
Et n1 = 1.0 10-1 mol.
Comme Kf = 4 1012 on peut considérer la réaction comme totale.
Détermination de l’état final :
Hypothèse n°1 : Le réactif limitant est Cu2+.
Dans ce cas n0 – x = 0 et n0 = x = 1.0 10-2mol.
Donc en état final nNH3 = n1-4x = 0.060 mol.
Cette hypothèse est possible donc c’est elle qui est retenue (l’autre hypothèse aboutit sur une quantité finale de Cu2+ négative, donc impossible).
Concentrations en état final :
[NH3]EF = ![]() = 6.0 10-1 mol.L-1.
= 6.0 10-1 mol.L-1.
[Cu(NH3)42+]EF
= ![]() = 1.0 10-1 mol.L-1.
= 1.0 10-1 mol.L-1.
Pour déterminer [Cu2+]EF
on emploie Kf. soit : Kf = 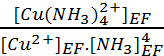 .soit [Cu2+]EF
=
.soit [Cu2+]EF
= 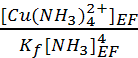 = 1.9 10-13 mol.L-1.
= 1.9 10-13 mol.L-1.
[Cu2+]EF
est proche de 0 : la réaction peut être considérée comme totale.
2.4 Détermination du nouveau
potentiel E’1.
E’1 = E0Cu2+/Cu + ![]() Log [Cu2+]EF = -0.04 V.
Remarque : E’1> E2, l »électrode de cuivre
est toujours la borne positive.
Log [Cu2+]EF = -0.04 V.
Remarque : E’1> E2, l »électrode de cuivre
est toujours la borne positive.
Donc E’ = E’1 – E2 = 0.75 V.