Exercice n°4 Bac STL BGB 2007 (septembre)

Corrigé
1. Etude de la molécule d’ammoniac.
1.1 H ; Z = 1 donc structure
électronique 1s1 et représentation de Lewis H![]() .
.
N ; Z = 7 donc
structure électronique 1s2 2s2 2p3
et représentation de Lewis ![]()
1.2 On obtient donc la molécule
NH3 suivante : 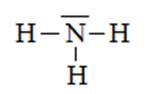
1.3 Suivant VSEPR il s’agit d’une
molécule de type AX3E1 donc de géométrie pyramidale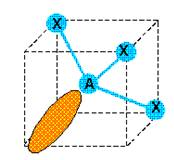
2. Le complexe diammineargent (I).
2.1 Ag+ + 2 NH3 = Ag(NH3)2+
2.2 Kf = 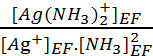
2.3 nAg+ = n1 = C1V1 = 2.5 10-3mol. nNH3 = n2 = C2.V2 = 0.02 mol.
2.4 Dans Vt = 0.5 L.
|
|
Ag+ |
+ 2 NH3 |
= Ag(NH3)2+ |
|
EI |
n1 |
n2 |
0 |
|
EF |
n1 – x =0 |
n2- 2x = 0.015 mol |
x = 2.5 10-3mol |
Détermination de x :
Hypothèse : Ag+ est le réactif limitant : n1-x = 0 donc x = n1 = 2.5 10-3 mol
Soit nNH3 EF = n2-2x = 0.015 mol.
Le résultat est possible donc cette hypothèse est validée.
2.5
Concentrations en état final :
[NH3]EF
= ![]() = 0.30 mol.L-1.
= 0.30 mol.L-1.
[Ag(NH3)2+]EF
= ![]() = 5.0 10-3 mol.L-1.
= 5.0 10-3 mol.L-1.
2.6 Pour déterminer [Ag+]EF
on emploie Kf. soit : Kf = 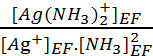 soit
soit
[Ag+]EF
= 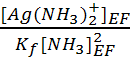 = 3.5 10-7 mol.L-1.
= 3.5 10-7 mol.L-1.
[Ag+]EF
est bien proche de 0, la réaction peut être considérée comme totale.
3. Potentiel de l’électrode.
3.1 On a E = EAg+/Ag0
+ ![]() Log [Ag+]
Log [Ag+]
3.2 Log [Ag+]
= 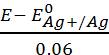 = - 6.5 donc [Ag+]= 10-6.5
= 3.2 10-7mol.L-1.
= - 6.5 donc [Ag+]= 10-6.5
= 3.2 10-7mol.L-1.
On a DC = 3.5 10-7 – 3.2 10-7 = 3.0 10-8 qui est inférieur à 10% de 3.5 10-7, qui est la concentration calculée au 2.6.