Exercice n°5 (Exercice quantitatif type BTS)
1.
Calculer la solubilité de AgBr en mol.L-1 et
en g.L-1 du bromure d’argent. pKs (AgBr) = 12.
2.
Dans un litre d’eau, on
ajoute 188 mg de bromure d’argent, sans variation de volume. Calculer le volume
d’ammoniac gazeux NH3 nécessaire à la redissolution
complète du précipité sachant que l’ammoniac forme avec les ions Ag+
le complexe Ag(NH3)2+. On considèrera que
l’addition de NH3 ne modifie pas le volume et que l’on peut négliger
la réaction de l’ammoniac avec l’eau.
Données :
Vm = 24 L.mol-1.
pKD(Ag(NH3)2+) = 7.2 ; MAg = 108 g.mol-1 ; MBr = 80 g.mol-1.
Corrigé
1. On a la réaction de précipitation (1) :
|
|
AgBr |
= Ag+ |
+ Br- |
|
EI |
n0 |
0 |
0 |
|
EF (saturation) |
n0 – x = n0
- s |
x = s |
x = s |
On
en déduit que Ks = [Ag+]EF.
[Br-]EF = s²
Donc
s = ![]() = 10-6 mol.L-1.
= 10-6 mol.L-1.
On
en déduit s’ = s.MAgBr = 1.88 10-4
g.L-1.
2. On
a la réaction de complexation (2): Ag+ + 2 NH3 =
Ag(NH3)2+
avec Kf
= 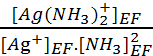 .
.
On en déduit donc la réaction
prépondérante (1) +(2)
|
|
AgBr |
+ 2 NH3 |
= Ag(NH3)2+ |
+ Br- |
|
EI |
n0 |
n1 |
0 |
0 |
|
EF |
n0 – x =0 |
n1-2x |
x |
x |
On a n0-x = 0 donc x=n0 = mAgBr/MAgBr = 10-3 mol.
KRP = 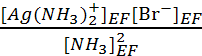 = Ks.Kf =
107.2.10-12 = 1.6 10-5.
= Ks.Kf =
107.2.10-12 = 1.6 10-5.
KRP
= 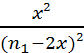 donc
donc ![]() =
= ![]() = 4.10-3 soit x =
= 4.10-3 soit x = ![]() (n1-2x)
(n1-2x)
Donc x = n1![]() - 2x
- 2x![]() et n1 =
et n1 = 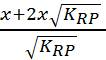 = 0.25 mol.
= 0.25 mol.
Soit V = n.Vm = 6.1 L.