Exercice n°6 (Exercice quantitatif type BTS)
On dispose
d’une solution d’éthanoate d’argent à 0.10 mol.L-1 (une partie est
dissoute et l’autre en suspension). Par ailleurs, on sait que les ions Ag+
peuvent donner un ion complexe de formule Ag(NH3)2+
avec l’ammoniac. On négligera toute variation de volume.
1. Déterminer les concentrations molaires en ions argents
et éthanoates dans la solution d’éthanoate d’argent.
2. Calculer la quantité de matière minimale d’ammoniac qu’il faut
ajouter à 1 litre de cette solution pour dissoudre totalement l’éthanoate
d’argent.
Données : Ks(CH3COOAg)
= 2 10-3. pKD(Ag(NH3)2+) = 7.2.
Corrigé
1. Equilibre de précipitation (1).
|
CH3COOAg |
= Ag+ |
+ CH3COO- |
|
|
EI |
n0 |
0 |
0 |
|
EF (saturation) |
n0 – x = n0
- s |
x = s |
x = s |
On
en déduit que Ks = [Ag+]EF.
[CH3COO-]EF = s²
Donc
s = ![]() = 4.5 10-2
mol.L-1.
= 4.5 10-2
mol.L-1.
1. Réaction
de complexation (2). Ag+ + 2 NH3 = Ag(NH3)2+ avec Kf = 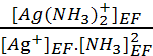 =
= ![]() = 107.2.
= 107.2.
Réaction prépondérante (1) +
(2)
|
|
CH3COOAg |
+ 2 NH3 |
= Ag(NH3)2+ |
+ CH3COO- |
|
EI |
n0 |
n1 |
0 |
0 |
|
EF |
n0 – x =0 |
n1-2x |
x |
x |
On a n0-x = 0 donc x = n0 = 10-1 mol.
KRP = 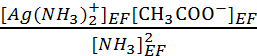 = Ks.Kf =
107.2.2.10-3 = 3.2 104.
= Ks.Kf =
107.2.2.10-3 = 3.2 104.
KRP
= 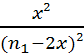 donc
donc ![]() =
= ![]() = 4.10-3 soit x =
= 4.10-3 soit x = ![]() (n1-2x)
(n1-2x)
Donc x = n1![]() - 2x
- 2x![]() et n1 =
et n1 = 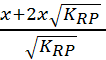 = 0.20 mol.
= 0.20 mol.
Cette valeur correspond
à celle attendue dans le cadre d’une réaction totale ( KRP
> 103).
2.