Exercice n°7 (Exercice quantitatif type BTS)
On
mélange, dans 1 litre total de solution, 0.1 mol de sulfate de cuivre et 0.4
mol d’ammoniac. Il se forme un complexe tétraamminecuivre
(II) dont KD = 2.5 10-13
1. Déterminer la concentration des diverses espèces en solution. On
négligera la réaction de l’ammoniac avec l’eau.
2. Pour quel pH, par ajout d’acide nitrique HNO3, le
complexe sera-t-il détruit à 50% ? pKA
(NH4+/NH3) = 9.2.
Corrigé
1. Dans V=1L
|
|
Cu2+ |
+ 4 NH3 |
= Cu(NH3)42+ |
|
EI (mol) |
n0 = 0.1 |
n1 = 0.4 |
0 |
|
EF (mol) |
n0 – x = 0.1 – x = e |
n1- 4x = 0.4 – 4x = 4e |
x = 0.1 mol. |
Kf = 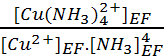 =
= ![]() = 4.1012 Donc on peut considérer la
réaction comme totale et
= 4.1012 Donc on peut considérer la
réaction comme totale et
n0-x = 0 et n0=x
=0.1mol.
Kf = 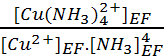 =
= ![]() =
= ![]() donc e =
donc e = 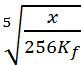 = 6.3 10-4mol.L-1.
= 6.3 10-4mol.L-1.
Donc [NH3]EF = 4e = 2.5 10-3
mol.L-1 et [Cu2+]EF = e = 6.3 10-4 mol.L-1.
2. Complexe détruit à 50% par ajout d’acide nitrique.
On a (1) NH3 + H3O+ = NH4+ + H2O qui traduit la réaction acide/base entre l’ammoniaque et l’acide.
Et (2) Cu(NH3)42+ = Cu2+ + 4 NH3 qui traduit l’équilibre entre le complexe déjà formé et ses constituants.
On en déduit la réaction prépondérante : 4(1) + (2).
|
|
Cu(NH3)42+ |
+ 4 H3O+ |
= 4 NH4+ |
+ Cu2+ |
+ 4 H2O |
|
EI (mol) |
n0 = 0.1 |
n1 |
0 |
0 |
Excès |
|
EF (mol) |
n0 – x =0.05 |
n1-4x |
4x = 0.2 |
x = 0.05 |
Excès |
On a n0-x = 0.05 donc x = 0.05 mol.
KRP =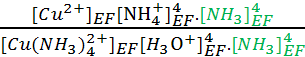 =
= 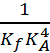 = 1.6 1024.
= 1.6 1024.
KRP
= 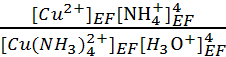 soit [H3O+]EF =
soit [H3O+]EF = 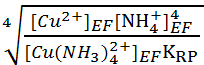 = 1.8 10-7 mol.L-1
= 1.8 10-7 mol.L-1
pH = - log [H3O+]EF = 6.7.
Il faut aboutir à une concentration d’ions H3O+ en état final de 1.8 10-7 mol.L-1 soit un pH = 6.7.