Exercice n°1
1. Etablir les structures électroniques des atomes suivants : 7N, 1H, 6C, 14Si, 8O, 5B, 9F, 16S, 15P, 17Cl, 53I.
2. En déduire les formules de Lewis puis les types VSEPR et les géométries des molécules et ions suivants. On fera un schéma afin de justifier les géométries et on discutera de l avaleur des angles entre les liaisons.
a- NH3.
b- CH4.
c- SiO2.
d- BF3.
e- H3O+.
f- PCl5.
g- SF6.
h- ICl3.
i- NH4+.
Corrigé
1. Structures électroniques :
1H : 1s1. Monovalent.
5B : 1s2
2s2 2p1 mais pour expliquer la trivalence du bore
on doit admettre qu’il est dans un autre état de valence : 1s2 2s1
2p2 ![]()
![]()
6C : 1s2
2s2 2p2 mais pour expliquer la tétravalence du
carbone on doit admettre qu’il est dans un autre état de valence : 1s2
2s1 2p3 ![]()
![]()
7N : 1s2
2s2 2p3. Trivalent avec un doublet non liant
externe.
8O : 1s2 2s2 2p4. Divalent avec deux doublets non liants externes.
9F : 1s2 2s2 2p5 . Monovalent avec trois doublets non liants externes.
14Si : 1s2
2s2 2p6 3s² 3p² mais pour expliquer la tétravalence du
silicium on doit admettre qu’il est dans un autre état de valence : 1s2
2s2 2p6 3s1 3p3 ![]()
![]()
15P : 1s2 2s2 2p6 3s² 3p3. Trivalent avec un doublet non liant externe. Il peut être dans un autre état de valence pour être pentavalent, un des électrons de l’orbitale 3s passant dans une autre orbitale vide.
16S : 1s2 2s2 2p6 3s² 3p4. Divalent avec deux doublets non liants externes. Il peut être hexavalent en passant dans un autre état de valence.
17 Cl : 1s2 2s2 2p6 3s² 3p5. Monovalent avec trois doublets non liants externes.
53I : 1s2 2s2 2p6 3s² 3p6 4s² 3d10 4p6 5s² 4d10 5p5 Monovalent avec trois doublets non liants externes. Il peut être dans un autre état de valence pour être trivalent : 1 doublet s’est scindé en deux électrons célibataires.
2. Formules de Lewis et géométries :
a- 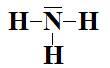 type
AX3E1 donc géométrie pyramidale.
type
AX3E1 donc géométrie pyramidale. 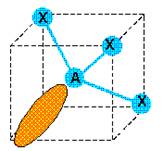 Le
doublet non liant repousse plus que les doublets liants : les angles entre
les liaisons sont inférieurs à 109°28’.
Le
doublet non liant repousse plus que les doublets liants : les angles entre
les liaisons sont inférieurs à 109°28’.
b- 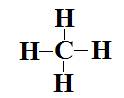 Type
AX4 donc géométrie tétraédrique.
Type
AX4 donc géométrie tétraédrique. 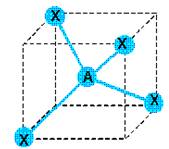 Angles
de 109°28’.
Angles
de 109°28’.
c- ![]() Type
AX2 donc molécule linéaire comme la représentation de Lewis. Angles
de 180°.
Type
AX2 donc molécule linéaire comme la représentation de Lewis. Angles
de 180°.
d- 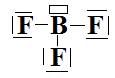 Type
AX3 donc géométrie trigonale plane :
Type
AX3 donc géométrie trigonale plane : 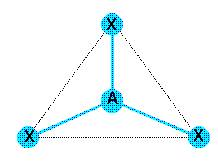 Angles
de 120°.
Angles
de 120°.
e- 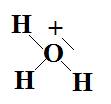 Type
AX3E1 donc géométrie pyramidale.
Type
AX3E1 donc géométrie pyramidale.  La
liaison entre H+ et H2O s’est faite par coordinence. Le
doublet non liant repousse plus que les doublets liants : les angles entre
les liaisons sont inférieurs à 109°28’.
La
liaison entre H+ et H2O s’est faite par coordinence. Le
doublet non liant repousse plus que les doublets liants : les angles entre
les liaisons sont inférieurs à 109°28’.
f- 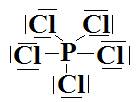 Type
AX5 donc géométrie en bipyramide trigonale.
Type
AX5 donc géométrie en bipyramide trigonale. 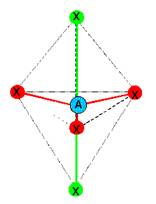 Les
angles antre liaisons dans le même plan (en rouge) sont de 120° et les angles
entre liaisons vertes et rouges sont de 90°.
Les
angles antre liaisons dans le même plan (en rouge) sont de 120° et les angles
entre liaisons vertes et rouges sont de 90°.
g- 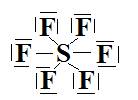 Type
AX6 donc géométrie octaédrique.
Type
AX6 donc géométrie octaédrique.  Les angles sont égaux à 90°. Le soufre est
dans un autre état de valence pour être hexavalent.
Les angles sont égaux à 90°. Le soufre est
dans un autre état de valence pour être hexavalent.
h- 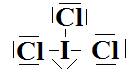 Type
AX3E2 donc géométrie en « T ».
Type
AX3E2 donc géométrie en « T ». 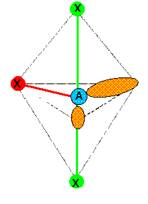 Les angles sont égaux à 90°. L’iode est dans
un autre état de valence pour être trivalent.
Les angles sont égaux à 90°. L’iode est dans
un autre état de valence pour être trivalent.
i- 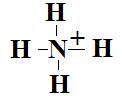 Type
AX4 donc géométrie tétraédrique.
Type
AX4 donc géométrie tétraédrique.
 Angles de 109°28’.
Angles de 109°28’.