Exercice n°2
Les éléments aluminium (Al ; Z=13) et chlore (Cl; Z=17)
amènent à la formation du trichlorure d’aluminium AlCl3 et de
l’ion AlCl4-.
a-
donner la
configuration électronique de ces deux atomes ainsi que la répartition de leurs
électrons dans leurs cases quantiques de la couche externe.
b-
En déduire leur
représentation de Lewis.
c-
Expliquer la
formation des liaisons dans AlCl3 et indiquer la géométrie de cette
molécule (faire un schéma). Discuter de la valeur des angles de liaisons.
d-
Expliquer la
formation des liaisons dans AlCl4- et indiquer la
géométrie de cet ion (faire un schéma). Discuter de la valeur des angles de
liaisons.
e-
Sous l’élément
aluminium dans le tableau périodique, on trouve l’élément Ga (Galium) Z=31.
Donner sa configuration électronique ainsi que la répartition des électrons
dans les cases quantiques de sa couche externe. Quelle caractéristique partage
t’il avec l’aluminium ?
Corrigé
a- Al : 1s² 2s²
2p6 3s23p1 soit ![]()
![]()
Cl : 1s² 2s² 2p6 3s23p5
soit ![]()
![]()
b- On en déduit : ![]() et
et 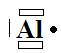
Mais cette représentation de Lewis n’explique pas la trivalence de l’aluminium (dans AlCl3 par exemple) qui appartient à la treizième colonne du tableau où les éléments sont trivalents.
L’aluminium est donc dans un autre état de valence : Al :
1s² 2s² 2p6 3s13p2 soit ![]()
![]() et on en déduit sa représentation de Lewis :
et on en déduit sa représentation de Lewis :

c- A partir des représentations de Lewis
du chlore et de l’aluminium trivalent on obtient 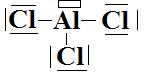
Son type VSEPR est AX3 donc sa
géométrie est trigonale plane.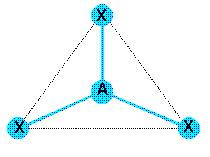 Les angles entre liaisons sont tous de 120°.
Les angles entre liaisons sont tous de 120°.
d- Une liaison se forme par coordinence
entre un ion Cl- ( 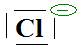 )
qui dispose de doublets externes et AlCl3 qui dispose d’une case
quantique vide.
)
qui dispose de doublets externes et AlCl3 qui dispose d’une case
quantique vide.
On obtient : 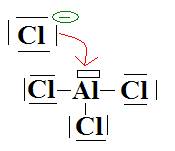 soit
soit
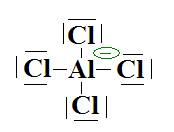 qui
est du type AX4 donc tétraédrique :
qui
est du type AX4 donc tétraédrique : 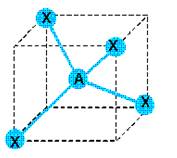
Les angles ont tous une valeur de 109°28’.
e- 31Ga : 1s² 2s² 2p6
3s² 3p6 4s² 3d10 4p1 ![]()
![]() .Il
appartient à la même famille que l’aluminium et a donc le même nombre d’électrons
externes (3 électrons) et dons la même valence. Il est trivalent en étant dans
un autre état de valence, comme l’aluminium.
.Il
appartient à la même famille que l’aluminium et a donc le même nombre d’électrons
externes (3 électrons) et dons la même valence. Il est trivalent en étant dans
un autre état de valence, comme l’aluminium.