Exercice n°3
A l’aide de la méthode VSEPR, analyser chacun des carbones
des molécules suivantes afin de connaître leur « type » et leur
géométrie.
En déduire si la molécule
complète est plane ou non plane.
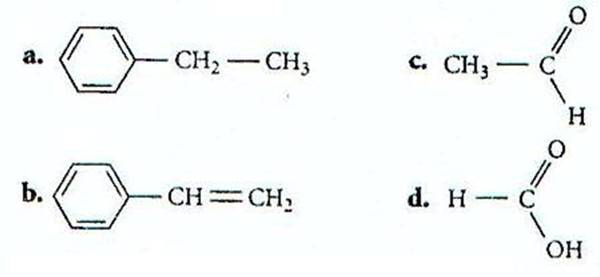
Corrigé
a- Cette molécule contient un cycle aromatique dont tous les carbones sont AX3 donc ont une géométrie trigonale plane, on en déduit que le cycle est plan. En effet chaque carbone du cycle a une double liaison vers un autre carbone et deux liaisons simples, une vers un carbone et l’autre vers un hydrogène non représenté, ils sont donc AX3.
Cependant cette molécule contient un groupe –CH3 qui est de type AX4 donc tétraédrique et non plan.
Cette partie n’est donc pas plane et la molécule dans son ensemble n’est donc pas plane.
b- Le cycle aromatique est plan (voir ci-dessus). Le carbone –CH= est de type AX3 donc de géométrie trigonale plane et le carbone =CH2 est également de type AX3 et de même géométrie.
On en conclue que puisque tous les atomes de cette molécule sont de géométrie trigonale plane et qu’ils sont liés entre eux, la molécule dans son ensemble est plane.
c- Cette molécule contient un –CH3 qui est de type AX4 donc tétraédrique et non plan.
Cette partie n’est donc pas plane et la molécule dans son ensemble n’est donc pas plane.
d- Le groupement H-C=O est de type AX3 donc de géométrie trigonale plane et cette partie de la molécule est plane. Le groupement –O-H est de type AX2E2 donc en « V ». En effet l’atome central est l’oxygène et il porte deux doublets non liants et deux liaisons simples (AX2E2).
Avec une partie trigonale plane et une partie en V cette molécule peut être plane si la partie en « V » se situe dans le même plan que la partie trigonale plane, mais ce n’est pas une obligation.