Exercice n°4
On donne les numéros atomiques des éléments suivants :
C : Z=6 ; H : Z=1 ; S : Z=16 ;
O :Z=8 et Cl :Z=17.
Donner les géométries des molécules suivantes en les
analysants avec la méthode VSEPR. Indiquer le type de chacun des atomes
centraux, analyser successivement chacun des atomes centraux lorsqu’il y en a
plusieurs.
|
a-
C2H6 b-
C2H2
e- OCCl2 |
c-
CH2Cl2 d-
C2H4 |
Corrigé
On a d’abord représenté les représentations de Lewis des molécules.
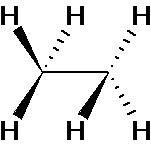
a- 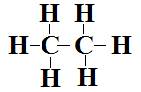 Les
deux carbones sont de type AX4. La première partie a donc une
géométrie tétraédrique comme la seconde partie de la molécule. On obtient une
molécule ayant la géométrie suivante :
Les
deux carbones sont de type AX4. La première partie a donc une
géométrie tétraédrique comme la seconde partie de la molécule. On obtient une
molécule ayant la géométrie suivante :
b- ![]() Les deux carbones sont de type AX2.
Les deux parties de la molécule ont une géométrie linéaire et la molécule dans
son ensemble est linéaire.
Les deux carbones sont de type AX2.
Les deux parties de la molécule ont une géométrie linéaire et la molécule dans
son ensemble est linéaire.
c- 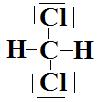 Le
carbone central est de type AX4 et cette molécule a une géométrie
tétraédrique.
Le
carbone central est de type AX4 et cette molécule a une géométrie
tétraédrique.
d- 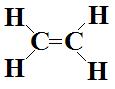 Les
deux atomes de carbones sont de type AX3 et ont donc des géométries
trigonales planes. La molécule dans son ensemble est dons plane. Elle a la même
forme que sa représentation de Lewis.
Les
deux atomes de carbones sont de type AX3 et ont donc des géométries
trigonales planes. La molécule dans son ensemble est dons plane. Elle a la même
forme que sa représentation de Lewis.
e- 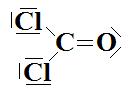 Le
carbone central est de type AX3, cette molécule a donc une géométrie
trigonale plane.
Le
carbone central est de type AX3, cette molécule a donc une géométrie
trigonale plane.