Exercice n°1
Quel est le
produit de solubilité de PbSO4 si on peut en dissoudre 7 mg dans 200
ml d’eau pure ?
Corrigé
Détermination de la solubilité de
PbSO4 : s = ![]() avec n =
avec n = 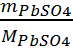 =
= ![]() =
2.3 10-5 mol.
=
2.3 10-5 mol.
Donc s = 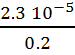 =
1.2 10-4 mol.L-1 c’est la concentration de saturation de
PbSO4 dans l’eau pure.
=
1.2 10-4 mol.L-1 c’est la concentration de saturation de
PbSO4 dans l’eau pure.
On a :
|
|
PbSO4 |
= Pb2+ |
+ SO42- |
|
EI |
n0 |
0 |
0 |
|
EF (saturation) |
n0 – x = n0
- s |
x = s |
x = s |
On en déduit que Ks = [Pb2+]EF.
[SO42-]EF = s² = 1.4 10-8.