Exercice n°3
Quel volume
minimum de Fe(IO3)2 à 1 mol.L-1 faut-il
ajouter à un litre d’une solution de chlorure de zinc à 0.1 mol.L-1
pour que la précipitation commence ? Ks(Zn(IO3)2 = 4.10-6.
Corrigé
Mises en solution :
· Fe(IO3)2 = Fe2+
+ 2 IO3- (totale) On
remarque que nIO3- = 2nFe(IO3-)
· ZnCl2 = Zn2+ +
2 Cl- . (totale)
Concentrations :
· [Zn2+]EI = nZn2+ / Vt = C1 V1 / (V1+V2)
· [IO3-]EI = nIO3-
/Vt =
2C2 V2 / (V1+V2).
Précipitation : Zn(IO3)2 =
Zn2+ + 2 IO3-
|
|
Zn(IO3)2 |
= Zn2+ |
+ 2 IO3- |
|
EI |
n0 |
0 |
0 |
|
EF (saturation) |
n0 – x = n0
- s |
x = s |
2x = 2s |
On a donc Ks = [Zn2+]EF.
[IO3-]²EF = 4s3
· Condition de précipitation : On doit avoir Pi
> Ks
soit
[Zn2+]EI. [IO3-]²EI> Ks
Soit :
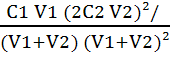 > Ks. On
est à la limite de la précipitation si
> Ks. On
est à la limite de la précipitation si 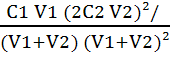 = Ks.
= Ks.
· Approximation : la variation de volume est négligeable donc V1
= (V1+V2).
On
obtient donc Ks = : 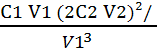 soit Ks =
soit Ks = 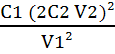 donc V22
=
donc V22
= 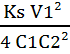 = 10-5
= 10-5
Donc
V1 = 3.2 10-3L.