Exercice n°5
Calculer la solubilité de
Mg(OH)2.
1. Dans l’eau pure. En déduire le pH d’une solution
saturée.
2. Dans une solution tamponnée à pH=8.5. Commenter ce
résultat.
Ks (Mg(OH)2) = 2.10-11.
Corrigé
1. Mg(OH)2
= Mg2+ + 2 OH-
|
|
Mg(OH)2 |
= Mg2+ |
+ 2 OH- |
|
EI |
n0 |
0 |
0 |
|
EF (saturation) |
n0 – x = n0
- s |
x = s |
2x = 2s |
On
a donc Ks = [Mg2+]EF.
[OH-]²EF = 4s3
s = ![]() = 1.7 10-4 mol.L-1.
= 1.7 10-4 mol.L-1.
[OH-]EF
= 2s = 3.4 10-4 mol.L-1. [H3O+]EF
= Ke/[OH-]EF
=2.9 10-11 mol.L-1.
pH =-Log
[H3O+]EF = 10.5
2. On nomme s’ la solubilité de Mg(OH)2 dans ces conditions. La concentration de l’ion hydroxyde est fixe et celle de l’ion Mg2+ est s’.
Ks = [Mg2+]EF.
[OH-]²EF = s’ x( Ke / 10-pH)2 donc s’ = 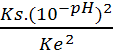 =2 mol.L-1
=2 mol.L-1
Donc la solubilité a augmenté fortement car le milieu
est plus acide. Le milieu artificiellement plus acide que si l’on faisait la
dissolution dans de l’eau pure amène une disparition des ions hydroxydes et
donc favorise le sens 1 de la réaction donc la dissolution.