Exercice n°8
Une pile est constituée ainsi :
Demi-pile 1 : Une lame d’argent
plongeant dans une solution de nitrate d’argent à 0.2 mol.L-1.
Demi-pile 2 : Une lame d’argent
plongeant dans une solution saturée de chlorure d’argent.
Les deux demi-piles sont reliées par
un pont électrolytique.
1.
Faire un schéma
de la pile.
2.
La fém. est égale
à +0.25V. calculer les potentiels de chacune des électrodes.
3.
Calculer la
concentration en ions Ag+ dans la demi-pile 2 et en déduire le
produit de solubilité du chlorure d’argent.
4.
En déduire le pKs
de AgCl et la solubilité de AgCl en g.L-1.
Donnée : E0Ag+/Ag = 0.80 V. MAg
= 108 g.mol-1 MCl = 35.5 g.mol-1.
Corrigé
1.
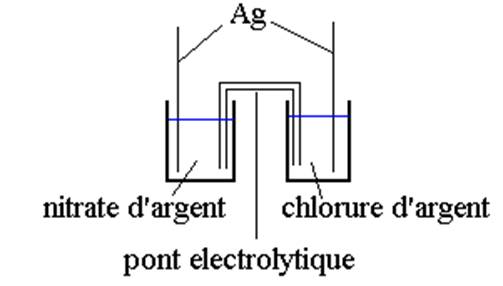
2.
On a : E1
– E2 = 0.25V et pour la demi-pile 1 on peut écrire :
E1 = E0Ag+/Ag
+ 0.06 /1 Log [Ag+] = 7.5 .10-1 V. (Car la concentration de l’ion argent
est égale à celle de nitrate d’argent, soit 0.2 mol.L-1.)
On en déduit E2 = E1 – 0.25 = 0.50 V.
3.
On a E2
= E0Ag+/Ag + 0.06 /1 Log [Ag+]2 où
[Ag+]2 représente la concentration de l’ion argent dans
la demi-pile 2.
Donc Log [Ag+]2 =
(E2 - E0Ag+/Ag)/0.06 = -5 et [Ag+]2
= 10-5 mol.L-1.
On a :
|
|
AgCl |
= Ag+ |
+ Cl- |
|
EI |
n0 |
0 |
0 |
|
EF (saturation) |
n0 – x = n0
- s |
x = s |
x = s |
On a s = 10-5 mol.L-1
d’après ci-dessus.
On en déduit que Ks = [Ag+]EF.
[Cl-]EF = s² = [Ag+]22 =
10-10puisqu’il s’agit d’une solution saturée dans de l’eau pure.
pKs = - log (Ks) = 10. Et s’ = s. MAgCl =
1.4 10-3 g.L-1.