Exercice n°1
Sujet de baccalauréat STL-BGB
1997
On réalise une pile
électrochimique afin de déterminer le produit de solubilité du sulfate d’argent
Ag2SO4
On réalise pour cela deux
demi-piles.
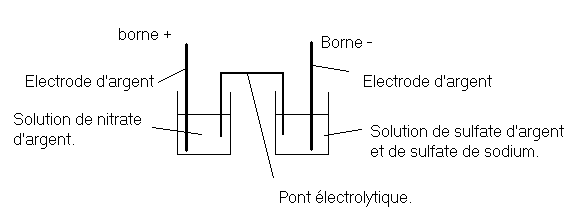
· Première demi-pile : On dissout, sans variation
de volume, 20.4g de nitrate d’argent (AgNO3) dans 150 mL d’eau pure.
Un fil d’argent sert d’électrode.
· Deuxième demi-pile : le bécher contient une
solution saturée de sulfate d’argent en présence d’un excès de sulfate de
sodium. L’électrode est un fil d’argent.
· Les deux demi-piles sont reliées par un pont
électrolytique.
1.
Exprimer et
calculer le potentiel de la première demi-pile.
2.
La force
électromotrice de la pile est égale à 0.120 V.
2.1
Calculer le
potentiel de la deuxième demi-pile et en déduire la concentration molaire des
ions Ag+.
2.2
Faire un schéma
de la pile en justifiant les polarités des électrodes.
3.
La concentration
en ions SO42- dans la deuxième demi-pile vaut 0.25 mol.L-1.
Calculer le produit de solubilité du sulfate d’argent.
4.
Calculer la
solubilité de Ag2SO4 dans l’eau pure.
Données :
MAg = 108 g.mol-1
MN = 14 g.mol-1 MO = 16 g.mol-1 MS
= 32 g.mol-1
E0Ag+/Ag
= 0.80 V
Corrigé
1-
Potentiel de la première
demi-pile:
· EAg+/Ag = E0 Ag+/Ag
+ 0.06/1 Log [ Ag+] = 0.794 V.
· MAgNO3= 170 g.mol-1 .
n AgNO3= m/ M = 20.4/170 = 0.12 mol.
· [ Ag+] = n/v = 0.12/0.15 = 0.8
mol.L-1 .
2-
Upile = E+
- E- ;
·
E- =
E+ - Upile = 0.79 - 0.12 = 0.67 V .
· E- = E0 Ag+/Ag
+ 0.06/1 Log [ Ag+] (Solution du
deuxième becher)
· Log [ Ag+] = (E- -
E0 Ag+/Ag )/ 0.06 = -2.16
· [ Ag+] = 10-2.16 = 6.8
10-3 mol.L-1 .
· Schéma d’une pile :
3-
Ag2SO4 = 2 Ag+
+ SO4 2- . Ks = [
Ag+]2.[ SO4
2- ] = 1.1 10-5 .
4-
D’après l’équation bilan
ci-dessus, si s = [ SO4 2- ] alors [ Ag+] = 2s
·
Ks = (2s)2 . s = 4 s3 ;
s = ( Ks/4 ) 1/3 = 1.4 10-2 mol.L-1 .