Exercice n°3
1- On plonge une électrode de platine dans une solution
contenant les ions aux concentrations suivantes :
[Cr2O72-]
= 10-2 mol.L-1, [Cr3+] = 10-3 mol.L-1,
à pH=1.
a-
Donner
l’expression du potentiel pris par l’électrode de platine.
b- Calculer ce potentiel.
2- On plonge une autre électrode de platine dans une
solution contenant les ions aux concentrations suivantes :
[Fe2+]
= 10-3 mol.L-1, [Fe3+] = 10-1 mol.L-1.
Déterminer le potentiel de cette électrode.
3- On relie ces deux demi-piles par un pont
électrolytique.
a-
Faire un schéma
de la pile sur lequel on indiquera la polarité de chaque électrode ainsi que le
sens de circulation des électrons lorsque la pile débite dans un conducteur
ohmique.
b- Déterminer la force électromotrice, E, de cette pile.
c-
Ecrire l’équation
de fonctionnement de cette pile.
Données :
E0Cr2O72-/Cr3+
= 1.33 V et E0Fe3+/Fe2+ = 0.77 V
Corrigé
1- Cr2O72-
+ 14 H+ + 6é = 2 Cr3+ + 7 H2O
a-
Eélectrode = E0Cr2O72-/Cr3+
+ 0.06/6 Log ([Cr2O72- ] [H3O+]14
)/ [Cr3+]2
b- E1= E0Cr2O72-/Cr3+
+ 0.01 Log ( 10-2. (10-1)14 / (10-3)2
=
1.33 – 0.01 x 10
= 1.23 V
2- E2 = E0Fe3+/Fe2+
+ 0.06/1 Log [Fe3+]/ [Fe2+]
= 0.77 + 0.06 Log 10-1/
10-3
= 0.89 V
3-
a- Schéma d’une pile :
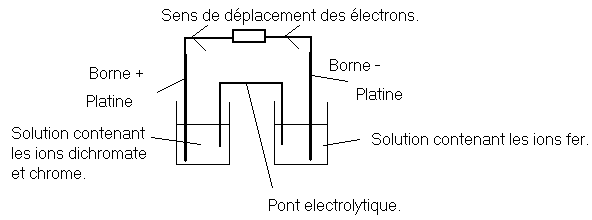
b-
Upile = E+ - E- = 1.23 – 0.89 = 0.34 V
c-
Equation bilan globale de la pile :
· Elle suit la règle du gamma :
· Pole positif (1): Cr2O72-
+ 14 H+ + 6é → 2 Cr3+
+ 7 H2O
· Pole négatif (2): Fe2+ → Fe3+ + é
· Bilan global : (1) +
6x(2)
·
Cr2O72- + 14 H+
+ 6Fe2+ = 2 Cr3+ + 7 H2O + 6 Fe3+