Exercice n°4
Afin de réaliser une pile, on
constitue deux demi-piles qu’on relie à l’aide d’un pont électrolytique. La
première demi-pile est constituée d’une lame d’argent plongeant dans une
solution de nitrate d’argent de concentration 0.2 mol.L-1. La
seconde est constituée d’une lame d’argent plongeant dans une solution de
chlorure d’argent saturée.
1.
Faire un schéma
de la pile.
2.
La première
électrode est le pôle positif de cette pile, et la force électromotrice de la
pile est E=0.25V. Déterminer les potentiels des deux électrodes.
3.
En déduire la
concentration en ions Ag+ dans la seconde demi-pile et calculer le
produit de solubilité du chlorure d’argent Ks.
4.
En déduire le pKs
et la solubilité de AgCl en g.L-1.
Corrigé
1- Schema de la pile :
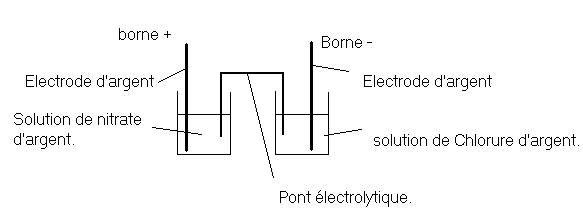
2- Ag+
+ é = Ag et Upile = E+ - E-
= 0.25 V
· Electrode A : E+ = E0Ag+/Ag
+ 0.06/1 Log [Ag+] = 0.76 V
· Electrode B : E- = E+ - Upile =
0.76-0.25 = 0.51 V
3-
Calcul de la concentration en ion argent dans la deuxième demi-pile.
· E- = E0Ag+/Ag
+ 0.06/1 Log [Ag+]’
· Log [Ag+]’ =(E- -
E0Ag+/Ag )/ 0.06 = -4.8
· [Ag+]’ = 10 – 4.8
= 1.6 10-5 mol.L-1 .
Determination du Ks : AgCl ↔ Ag+ + Cl-
· Ks = [Ag+] [Cl-]
·
D’aprés bilan
molaire, [Ag+] = [Cl-] = s = 1.6 10-5 mol.L-1.
·
Donc Ks = s2
= 2.6 10-10
1- Calcul du pKs :
·
pKs = - Log Ks =
9.6
·
s = √Ks =
1.6 10 -5 mol.L-1.
·
MAgCl =
143.4 g.mol-1
·
s’ = s. MAgCl
= 2.3 10-3 g.mol-1.