Exercice n°1
La vitamine
c est de l’acide ascorbique de formule C6H8O6
que l’on considérera comme un monoacide. On dissout un comprimé contenant cette
vitamine dans 100.0 cm3 d’eau distillée et on dose cette solution A
par une solution d’hydroxyde de sodium à 3.00 10-1 mol.L-1.
Seules les
réactions acido-basiques seront prises en compte.
On obtient
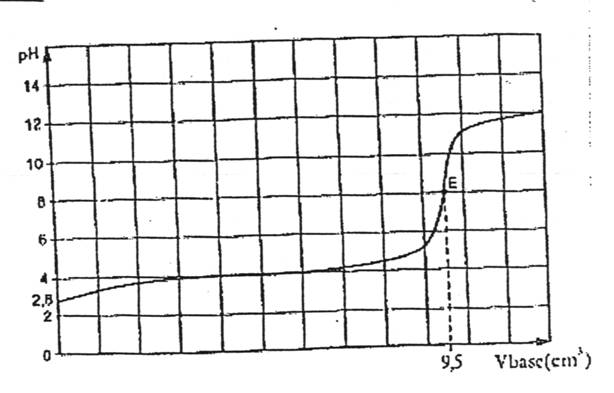
la courbe ci-dessous.
1- L’acide ascorbique est il un acide fort ou
faible ? Justifier. Ecrivez l’équation bilan de sa réaction avec l’eau puis
la soude.
2- A l’aide de cette courbe déterminez :
a- le pKa du couple acide base étudié.
b- La concentration de l’acide dans la solution A et la
masse d’acide ascorbique dissoute dans les 100.00 cm3 d’eau.
3-
a- Déterminer les concentrations de toutes les espèces
présentes dans la solution A.
b- Déduisez Ka et pKa et comparer au résultat du 2a.
4- Calculer le facteur d’ionisation de l’acide dans la
solution A. Conclure. (On rappelle que le facteur d’ionisation est le rapport
du nombre de molécules ionisées au nombre de molécules mises en solution.)
Données : MC=
Corrigé
1-
On remarque que
le pH à l’équivalence est basique, l’acide ascorbique est donc un acide faible.
On peut également remarquer que la courbe de dosage présente un point
d’inflexion à la demi-équivalence (la courbe traverse la tangente tracée à la
demi-équivalence).
Mise en solution : C6H8O6 + H2O
= C6H7O6- + H3O+
(limitée)
Dosage : C6H8O6 + OH-
= C6H7O6- + H2O (totale)
2-
a- A la
demi-équivalence on a pH = pKa donc pKa = 4.
b- Détermination de la concentration de l’acide
ascorbique :
|
|
C6H8O6 + |
OH-
= |
C6H7O6-
+ |
H2O |
|
EI |
n0 |
nv |
0 |
excès |
|
EF |
n0-x |
nv-x |
x |
excès |
A l’équivalence, tous les réactifs ont
disparus, donc n0-x =0 , nv-x
= 0 et n0 = nv donc
[C6H8O6].E
= [OH-].Veq , donc [C6H8O6]
= [OH-].Veq / E. =
3.00 10-1x 9.5 / 100
= 2.85 10-2
mol.L-1.
On a n0
= [C6H8O6].E = 2.85 10-3 mol et n0
= macide/Macide
Soit macide
= n0.Macide =2.85.10-3x 176 =
3-
a- Mise en
solution de l’acide ascorbique :
Pour un volume V=100 mL.
On néglige
l’autoprotolyse de l’eau.
|
|
C6H8O6 + |
H2O
= |
C6H7O6- + |
H3O+ |
|
EI |
n0 |
excès |
0 |
0 |
|
EF |
n0-x |
excès |
x |
x |
n0 = 2.85 10-3 mol.
On a [C6H8O6]EF
= (n0-x)/V ; [C6H7O6-]EF
= x/V et [H3O+]EF = x/V.
Comme [H3O+]EF
= 10-pH = 10-2.8 =
1.6 10-3 mol.L-1 et que [H3O+]EF
= x/V. ( avec V=100 mL) on en déduit que
x= 1.6 10-3 x 100 10-3 =
1.6 10-4 mol.
Donc [C6H8O6]EF
= (n0-x)/V = 2.69 10-2 mol.L-1 ; [C6H7O6-]EF
= x/V= 1.6 10-3 mol.L-1 ;
[OH-]EF
= Ke/ [H3O+]EF = 6.3 10-12 mol.L-1.
b- Ka = [C6H7O6-]EF.
[H3O+]EF/[ C6H8O6]EF
= 9.52 10-5 et pKa = - Log Ka = 4.02
Le pKa
correspond à celui lu sur la courbe.
4-
On a α = x/n0
= 0.056 c'est-à-dire 5.6%.