Exercice n°4
On dose au
pHmètre 100 mL d’une solution d’acide éthanoïque par de l’hydroxyde de sodium
de concentration molaire égale à 0.10 mol.L-1.
1- Quelles électrodes faut-il utiliser pour ce
dosage ?
2- Déterminer sur la courbe le pH et le volume de soude au
point équivalent.
3- En déduire la concentration initiale C0
d’acide éthanoïque.
4- Quelle constante caractéristique peut-on déduire à la
demi-équivalence ?
5- Etablir la relation donnant le pH de la solution
initiale d’acide éthanoïque en fonction de C0 et de la constante
trouvée précédemment. Calculer la valeur de ce pH et la comparer à celle qui
est lue sur le graphe.
6- Quel indicateur coloré conviendrait pour repérer
l’équivalence de ce dosage ?
7- Citer une autre méthode instrumentale de dosage de
l’acide éthanoïque.
|
Indicateur |
couleur |
pH |
pH |
couleur |
|
Phénolphtaléine |
incolore |
8.2 |
9.8 |
Rouge-violet |
|
Rouge de méthyl |
rouge |
4.4 |
6.2 |
Jaune -orange |
|
BBT |
jaune |
6.0 |
7.6 |
bleu |
Courbe
de dosage :
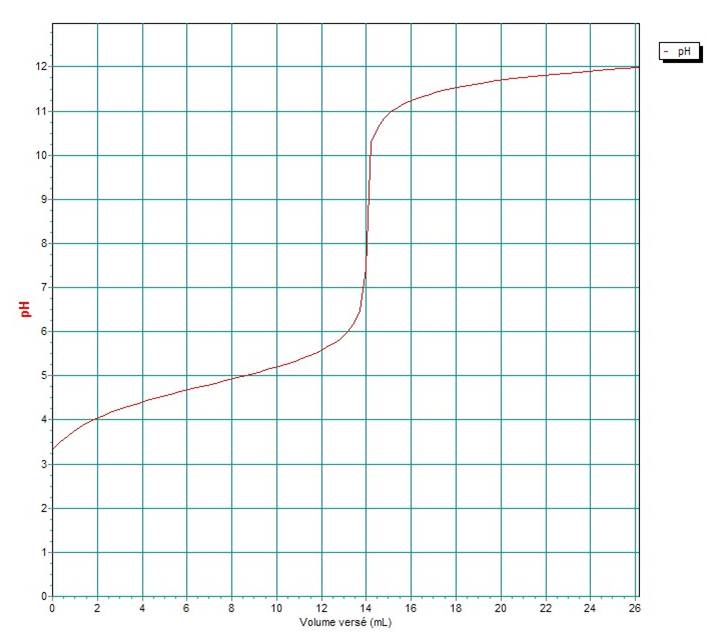
Corrigé
1-
On emploie une électrode
combinée : Pour l’électrode de référence, il s’agit d’une électrode au
calomel saturé et pour l’électrode de mesure, une électrode de verre.
2-
D’après la courbe
et à l’aide de la méthode des tangentes, on obtient Veq = 14 mL et
pHeq = 8.2.
3-
Réactions de mise
en solution (espèces prédominantes surlignées):
NaOH = Na+ + OH-
(dans l’eau) (totale).
CH3COOH + H2O = H3O+
+ CH3COO- (limitée)
Tableau d’avancement du dosage:
|
|
CH3COOH + |
OH- = |
CH3COO- + |
H2O |
|
EI |
n0 |
nv |
0 |
excès |
|
EF |
n0-x |
nv-x |
x |
excès |
A l’équivalence, tous les réactifs ont
disparus, donc n0-x =0 , nv-x
= 0 et n0 = nv donc
[CH3COOH].E
= [OH-].Veq , donc [CH3COOH] = [OH-].Veq/E
= 0.014 mol.L-1.
4-
A la
demi-équivalence, on a pH = PKa. D’après la courbe, en se plaçant à V=7 mL, on
lit pH = 4.8, donc le pKa de ce couple est pKa = 4.8.
5-
Tableau
d’avancement de la mise en solution de CH3COOH. Pour un volume V=1
L.
On néglige l’autoprotolyse de l’eau.
|
|
CH3COOH + |
H2O = |
CH3COO- + |
H3O+ |
|
EI |
n0 |
excès |
0 |
0 |
|
EF |
n0-x |
excès |
x |
x |
n0 = C0.V = 0.014 mol.
Numériquement, C0 = n0.
On a [CH3COOH]EF
= (n0-x)/V ; [CH3COO-]EF = x/V
et [H3O+]EF = x/V.
Ka = [CH3COO-]EF.
[H3O+]EF/[CH3COOH]EF =
(x/V).(x/V)/ ((n0-x)/V)
Comme V =
1L, Ka = x²/n0-x et comme on peut faire l’approximation que l’acide
est peu dissocié, on peut dire que n0-x est peu différent de n0.
Donc Ka = x²/n0 et x = (Ka.n0)1/2 = 4.7 10-4
mol.
Donc [H3O+]EF
= x/V= 4.7 10-4 mol.L-1 et pH = - Log [H3O+]EF
= - Log (Ka.n0)1/2
= - Log (Ka.C0)1/2 = 3.3.
6-
Le pHeq
est basique (puisque d’après l’équation bilan, à l’équivalence il ne reste dans
le bécher qu’une base, CH3COO-, et de l’eau avec des ions
spectateurs Na+), il faut choisir la phénolphtaléine.
7-
On aurait pu le
doser par conductimétrie.