Exercice n°5
On dose 20
cm3 d’une solution d’acide éthanoïque de concentration Ca par une
solution d’hydroxyde de sodium de concentration Cb et, à l’aide d’un pH-mètre,
on suit l’évolution du pH. On obtient le tableau suivant :
|
Vb (cm3) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
pH |
2.85 |
3.8 |
4.2 |
4.4 |
4.6 |
4.7 |
4.8 |
4.9 |
5.1 |
|
|
Vb (cm3) |
9 |
9.5 |
9.8 |
10 |
10.2 |
10.5 |
10.8 |
11 |
12 |
13 |
|
pH |
5.4 |
5.9 |
7 |
8.75 |
10.5 |
11.4 |
11.8 |
12 |
12.4 |
12.6 |
1- Ecrire l’équation de réaction de dosage.
2- Tracer la courbe pH=f(Vb).
3- Déterminer graphiquement les coordonnées du point
équivalent et la valeur du pKa du couple CH3COOH/CH3COO-.
4- En utilisant le pH initial, déterminer la valeur de la
concentration de l’acide éthanoïque Ca et en déduire celle de la solution d’hydroxyde
de sodium Cb.
5- Parmi les indicateurs colorés suivants, lequel
pourrait-on choisir pour repérer l’équivalence ?
|
Indicateur |
couleur |
pH |
pH |
couleur |
|
Phénolphtaléine |
incolore |
8.2 |
9.8 |
Rouge-violet |
|
Rouge de méthyl |
rouge |
4.4 |
6.2 |
Jaune -orange |
|
BBT |
jaune |
6.0 |
7.6 |
bleu |
6- Comparer la force de cet acide à celle de l’acide
méthanoïque sachant que le pKa de HCOOH/HCOO- est 3.8.
7- Donner deux
méthodes, sans calculs, permettant d’obtenir une solution tampon de pH égal au
pKa du couple CH3COOH/CH3COO- à partir de la
solution d’acide éthanoïque précédente.
Corrigé
1-
Réaction de
dosage (totale) : CH3COOH + OH- = CH3COO-
+ H2O
|
|
|
|
|
2-
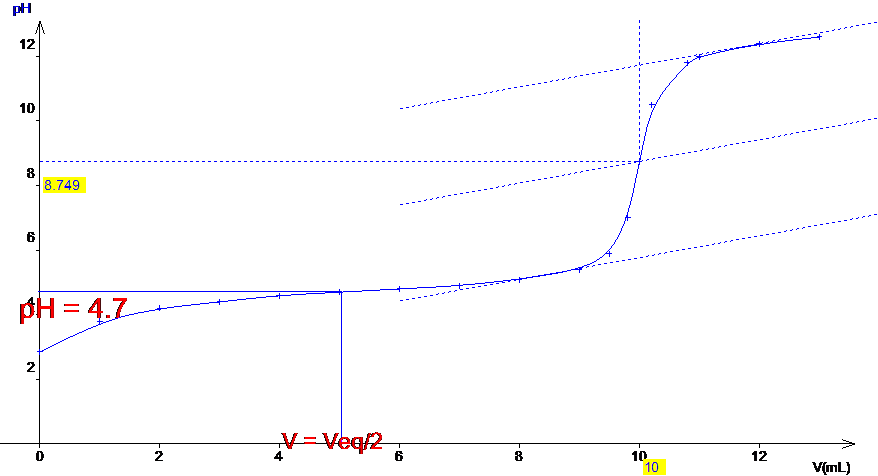
3-
D’après le
graphe, on obtient Veq = 10 mL et A la demi-équivalence on peut lire
le pKa (puisque pH = pKa à la demi-équivalence) soit pKa = 4.7.
4- Détermination
de Ca :
On a un pH initial : pHi = 2.85.
Tableau d’avancement de la mise en solution de CH3COOH.
Pour un volume V=1 L.
On néglige l’autoprotolyse de l’eau.
|
|
CH3COOH + |
H2O = |
CH3COO- + |
H3O+ |
|
EI |
n0 |
excès |
0 |
0 |
|
EF |
n0-x |
excès |
x |
x |
n0 = C0.V.
Numériquement, C0 = n0.
On a [CH3COOH]EF
= (n0-x)/V ; [CH3COO-]EF = x/V
et [H3O+]EF = x/V.
Ka = [CH3COO-]EF.
[H3O+]EF/[CH3COOH]EF =
(x/V).(x/V)/ ((n0-x)/V)
Comme V =
1L, Ka = x²/n0-x soit n0-x = x²/Ka. Donc n0 = (x²/Ka) + x
Comme [H3O+]EF
= 10-pH = 10-2.85
= 1.4 10-3 mol.L-1 et que [H3O+]EF
= x/V. ( avec V=1L) on en déduit que x= 1.4 10-3 mol.
Donc n0
= (x²/Ka) + x = ((1.4 10-3)² / 10-4.7) + 1.4 10-3
= 1.0 10-2 mol et C0
= n0/V = 1.0 10-2 mol.L-1.
Détermination de Cb :
Réactions de
mise en solution (espèces prédominantes surlignées):
NaOH = Na+ + OH-
(dans l’eau).
CH3COOH + H2O = H3O+
+ CH3COO-
Tableau d’avancement du dosage:
|
|
CH3COOH + |
OH- = |
CH3COO- + |
H2O |
|
EI |
n0 |
nv |
0 |
excès |
|
EF |
n0-x |
nv-x |
x |
excès |
A l’équivalence, tous les réactifs ont
disparus, donc n0-x =0 , nv-x
= 0 et n0 = nv donc
[CH3COOH].E
= [OH-].Veq , donc [OH-] = [CH3COOH].E
/ Veq. = 1.0 10-2x
20 / 10
= 2.0 10-2
mol.L-1 soit Cb = 2.0 10-2 mol.L-1.
5-
On remarque que
le point équivalent est en pH basique (puisque d’après l’équation bilan, à
l’équivalence il ne reste dans le bécher qu’une base, CH3COO-,
et de l’eau avec des ions spectateurs Na+) donc on choisit la
phénolphtaléine.
6-
Le pKa de l’acide
méthanoïque est plus bas, donc l’acide méthanoïque est un acide plus fort que
l’acide éthanoïque.
7-
Pour obtenir une
solution tampon de pH = pKa on peut :
· Doser la solution d’acide éthanoïque, à l’aide de soude
par exemple, jusqu’à la demi-équivalence. On a alors pH = pKa et [CH3COOH]EF=[CH3COO-]EF,
on est dans les conditions de la solution tampon.
· Réaliser un mélange équimolaire d’acide éthanoïque et
d’éthanoate de sodium. On aura alors [CH3COOH]EF=[CH3COO-]EF
et on se retrouvera dans le cas de figure précédent.