Exercice n°6 (BTS AB
2006)
On donne :
NH4+/NH3
pKa = 9.20 à 25°C
11H et 714N
L’ammoniac est un gaz
moléculaire de formule NH3n très soluble dans l’eau.
1- Structure.
1.1 Ecrire le modèle de Lewis de la molécule d’ammoniac.
1.2 Prévoir la géométrie de l’ammoniac à l’aide de la
théorie VSEPR (règles de Gillespie).
2- pH d’une solution. L’ammoniaque est une base faible,
son acide conjugué est NH4+
2.1En
utilisant le modèle de Lewis, justifier le caractère basique de l’ammoniaque.
2.2Ecrire
la réaction qui a lieu lors de l’introduction de l’ammoniaque dans l’eau.
3- On souhaite préparer une solution tampon à partir d’ammoniac.
3.1
Qu’est ce qu’une solution tampon ?
3.2
Sans calcul, donner l’ordre de grandeur du pH d’un tampon ammoniacal.
3.3
Citer un milieu naturellement tamponné.
Corrigé
1- Structure.
1.1
le modèle de
Lewis de la molécule d’ammoniac est
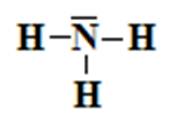
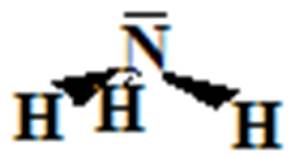
1.2
la géométrie de l’ammoniac
est pyramidale : c’est une molécule du type AX3E1 :
2
pH d’une solution.
L’ammoniaque est une base faible, son acide conjugué est NH4+
2.1
En utilisant le
modèle de Lewis, justifier le caractère basique de l’ammoniaque.
NH3
peut capter un ion H+ à l’aide de son doublet non liant : C’est
une base de Lewis puisqu’il possède un doublet non liant.
2.2
Ecrire la réaction
qui a lieu lors de l’introduction de l’ammoniaque dans l’eau.
NH3
+ H2O = NH4+ + OH-
3
On souhaite
préparer une solution tampon à partir d’ammoniac.
3.1
Qu’est ce qu’une
solution tampon ?
Une solution tampon est une solution
dont le pH varie extrêmement peu à la dilution ou lorsqu’on lui ajoute une quantité
modérée d’acide ou de base.
3.2 Le pH d’une solution tampon est proche de pKa du
couple employé, donc ici l’ordre de grandeur du pH de cette solution tampon est
de 9. ( 8.2< pH< 10.2 )
3.3 Le sang, la salive…