Exercice n°7 (BTS BT
2007)
Soit une solution aqueuse SA
contenant de l’acide méthanoïque à la concentration c= 2.30 mmol.L-1.
1- Cette solution
présente à 25.0 °C un pH égal à 3.25.
a- Ecrire la réaction de dissociation de l’acide dans l’eau
puis donner l’expression de la constante associée.
b- Exprimer les concentrations molaires [HCOOH] et [HCOO-]
en fonction de c et du pH.
c- En déduire les valeurs de Ka et de pKa,
cette dernière étant donnée avec deux décimales.
2- On mélange la solution précédente à une solution SB
de base forte (K++OH-) de concentration c’ = 8.00 mmol.L-1 ;
les volumes employés sont respectivement : VA = 100.0 cm3
et VB = 50.0 cm3.
a- Ecrire l’équation de la réaction prépondérante
intervenant au cours de ce mélange.
b- Quel est le réactif en excès ? Justifier.
c- Déterminer les concentrations molaires de toutes les
espèces majoritaires et le pH du milieu à l’état final.
Donnée :
le produit ionique de l’eau est égal à 1.00 10-14 à 25°C.
Corrigé
1-
a- HCOOH
+ H2O = HCOO- + H3O+ (limitée) Ka = 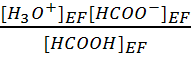
b- On a le tableau d’avancement suivant : (On néglige
l’autoprotolyse de l’eau)
Dans V = 1L
|
|
HCOOH + |
H2O = |
HCOO- + |
H3O+ |
|
EI |
n0 = cV |
excès |
0 |
0 |
|
EF |
n0-x |
excès |
x |
x |
On a [HCOOH]EF = (n0-x)/V =
(cV-x)/V = c-x car V=1
[HCOO-]EF
= x/V = x et [H3O+]EF
= x/V =x. par ailleurs On a [H3O+]EF = 10-pH
soit x = 10-pH
Donc [HCOOH]EF = c-10-pH ; [HCOO-]EF
=[H3O+]EF = 10-pH
c- Ka = 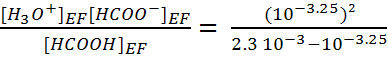 =
1.82 10-4 et pKa = - log Ka = 3.74
=
1.82 10-4 et pKa = - log Ka = 3.74
2-
a- HCOOH + OH- = HCOO-
+ H2O (totale) Il s’agit d’un dosage.
b- La base, l’hydroxyde de potassium, est le
réactif en excès, sa quantité de matière introduite
nb = Cb.Vb
= 8.00 10-3x50.0 10-3 = 4.00 10-4 mol est
supérieure à celle de l’acide
na = Ca.Va
= 2.30 10-3x100 10-3 = 2.3 10-4 mol et les
coefficients stœchiométriques des deux réactifs sont égaux à 1.
c- On a le tableau d’avancement
suivant :
|
|
HCOOH + |
OH- = |
HCOO- + |
H2O |
|
EI |
n0 = 2.3 10-4 |
nv = 4.00 10-4 |
0 |
excès |
|
EF |
n0-x
|
nv-x = 1.7 10-4
mol |
X = 2.3 10-4
mol |
excès |
HCOOH est le réactif en
défaut donc en état final [HCOOH]EF ![]() 0
soit n0-x = 0 et x=n0 = 2.3 10-4 mol.
0
soit n0-x = 0 et x=n0 = 2.3 10-4 mol.
Les résultats numériques
sont écrits dans le tableau.
Donc :
·
[OH-]EF = ![]() =
= 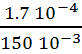 = 1.13 10-3 mol.L-1.
= 1.13 10-3 mol.L-1.
·
[HCOO-]EF =![]() =
= 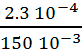 = 1.53 10-3 mol.L-1.
= 1.53 10-3 mol.L-1.
· [K+]EF = ![]() =
= 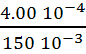 =
2.67 10-3 mol.L-1.
=
2.67 10-3 mol.L-1.
· Afin de déterminer le pH, il faut
déterminer [H3O+]EF =
Ke/[OH-]EF = 8.85 10-12
mol.L-1.
· HCOOH n’est pas une espèce
majoritaire, pas plus que H3O+. On peut déterminer la
concentration d’acide méthanoïque à l’aide du Ka.
pH = - log [H3O+]EF = 11.1