Exercice n°1
On donne le diagramme des niveaux d’énergie du sodium.

1. Que signifie le terme « quantifié », lorsqu’on dit que les niveaux d’énergie de l’atome de sodium sont quantifiés ?
2. Déterminer la longueur d’onde du photon émis lorsque l’atome de sodium se désexcite de son état E3 vers son état fondamental. A quel domaine des ondes électromagnétiques ce rayonnement appartient-il ?
3. Lorsqu’il est en état E3, le sodium peut-il émettre un photon de fréquence 2.66 1014 Hz ?
4. Quelle est l’énergie d’ionisation de l’atome de sodium ?
5. Quel type se spectre obtient-on avec une lampe à vapeurs de sodium (non ionisé) ? A quoi ressemble-t-il ?
Corrigé
1. Les niveaux d’énergie d’un atome sont quantifiés signifie qu’un atome ne peut pas prendre n’importe quelle énergie : il ne peut avoir que certaines énergies précises, les niveaux d’énergie.
2. On a Eph = E3 – E1 = -1.93 –(-5.14) =3.21 eV = 3.21 x 1.6 10-19 = 5.14 10-19 J
Or Eph = ![]() donc l =
donc l = ![]() = 3.86 10-7m ou encore 386 nm.
= 3.86 10-7m ou encore 386 nm.
Ce photon appartient au
domaine Ultra Violet : sa longueur d’onde est inférieure à 400 nm.
3. On
a Eph = h.n
= 1.76 10-19 J soit 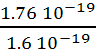 = 1.1 eV.
= 1.1 eV.
Pour que le photon
puisse être émis il faut que cette énergie corresponde à une transition
possible donc qu’il existe un état En tel que Eph = E3
– En soit En = E3 – Eph = -1.93
-1.1 = -3.03 eV.
Cet état existe, il s’agit
de E2 donc le photon peut être émis lorsque l’atome est en état E3.
4. On a Eionisation = E¥ -E1 = 5.14 eV.
5. On obtient un spectre de raies d’émission. Il s’agit d’un spectre composé de raies colorées sur fond noir. Le spectre est discontinu puisque les niveaux d’énergie de l’atome sont quantifiés et qu’il ne peut émettre que certains photons de longueurs d’ondes précises.