Exercice n°2 Bac STL BGB 2005
On a le
diagramme des niveaux d’énergie de l’atome d’hydrogène.
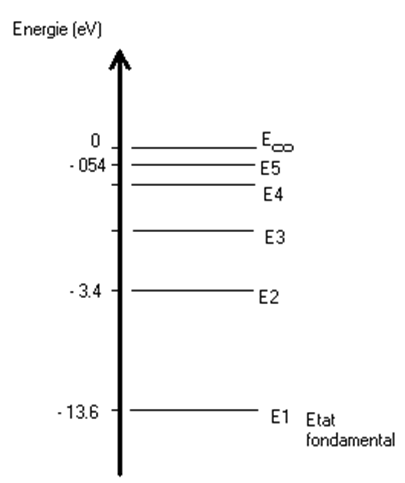
On donne les
constantes suivantes : c= 3,0.108 m.s-1 ; h =
6.62 10-34 J.s
On donne la
conversion suivante : 1 eV = 1.6 10-19 J.
1.
Quelle est en
Joule l’énergie d’ionisation de l’atome d’hydrogène au repos?
2.
L’atome d’hydrogène
est dans l’état excité E5, il se désexcite et passe dans l’état E2.
Sous quelle forme l’énergie est-elle libérée ? Calculer l’énergie libérée
en joule.
3.
Lorsqu’il est
dans son état fondamental, l’atome d’hydrogène est capable d’absorber un photon
de longueur d’onde 97.3 nm. Il passe alors dans l’état d’énergie E4.
Calculer la valeur de l’énergie de E4, qu’il faut reporter sur le
diagramme.
4.
Expliquer le
mécanisme d’absorption d’un photon par l’atome d’hydrogène.
5.
Si on réalise une
lampe à vapeurs d’hydrogène (non ionisé), quel type de spectre lumineux
obtiendra t-on en décomposant la lumière émise ?
Corrigé
1. D’après le diagramme, il faut fournir
13.6 eV pour ioniser l’atome
d’hydrogène.
Eion=E∞ - E1 = 13.6 eV
= 13.6x 1.6 10-19 =2.18 10-18 J.
2.
Sous
forme de rayonnement : un photon est émis.
Ephoton = E5-E2 = -0.54-
(-3.4) =2.86 eV = 2.86x1.6 10-19
=4.58 10-19 J.
3. Ephoton = h.c/λ = 6.62 10-34
x 3 108 / 97.3 10-9 = 2.04 10-18 J = 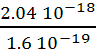 =12.75 eV.
Donc E4-E0= 12.75 eV et E4 = 12.75+E0=-0.84
eV.
=12.75 eV.
Donc E4-E0= 12.75 eV et E4 = 12.75+E0=-0.84
eV.
4. Un photon ne peut être absorbé par un atome que s’il
lui permet de passer dans un état d’énergie, possible, supérieur. Les états
d’énergie de l’atome sont quantifiés, ils ont des valeurs précises. L’énergie
du photon doit donc correspondre exactement à la différence d’énergie existant
entre deux niveaux d’énergie de l’atome (dont celui dans lequel est l’atome au
moment où il reçoit le photon) afin qu’il y ait absorption de ce dernier.
L’atome passe dans un état d’énergie excité supérieur à l’état d’énergie
précédent.
5. On obtiendra un spectre de raies d’émission, les niveaux d’énergie de l’atome d’hydrogène étant quantifiés, il ne peut émettre que certains photons de longueurs d’ondes précises.