Exercice n°3
On donne deux spectres (incomplets) obtenus à l’aide de vapeurs de mercure.
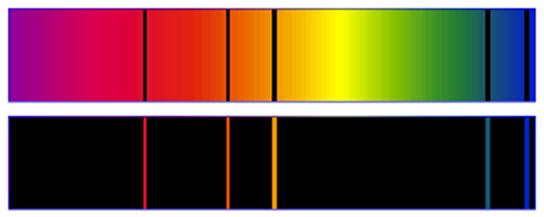
1. Quel est le spectre d’émission ? Quel est le spectre d’absorption ?
2. Faire un schéma simple indiquant comment on peut réaliser un spectre d’absorption de manière générale.
3. On trouve dans un document l’énergie d’ionisation du mercure : 1007 kJ/ mol. Déterminer l’énergie d’ionisation d’un atome de mercure en eV.
4. Déduire de la question précédente l’énergie de l’état fondamental de l’atome de mercure.
5. Les longueurs d’onde du doublet jaune représenté ci-dessus sont 578 et 579 nm. Construire une ébauche de diagramme simplifié des niveaux d’énergie du mercure permettant d’expliquer l’émission de ces raies. On admettra que l’émission de ces photons ramène à l’état fondamental.
6. Quelles informations faut-il pour construire le diagramme des niveaux d’énergie du mercure de manière complète ?
Données : NA = 6.02 1023 mol-1.
Corrigé
1. Le premier spectre est un spectre d’absorption, il est composé de raies noires sur un fond de spectre continu de la lumière blanche.
Le second spectre est un spectre d’émission de raies, il est composé de raies colorées sur fond noir.
2. Schéma du montage :

Les éléments principaux sont : une source de lumière blanche, une fente, une cuve contenant la substance absorbante, un prisme ou un réseau et un écran. Sur ce schéma, un condenseur a été ajouté entre la source et la fente et une lentille a été ajoutée avant le prisme.
3. Cette
énergie d’ionisation est relative à une mole de mercure on peut donc en déduire
l’énergie d’ionisation d’un atome. Eionisation = ![]() =
= ![]() = 1.673 10-18 J soit Eionisation
=
= 1.673 10-18 J soit Eionisation
= 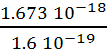 = 10.5 eV
= 10.5 eV
4. Comme Eionisation = E¥ -E1 on a E1 = E¥ - Eionisation = -10.5 eV = -1.68 10-18J (par définition E¥ = 0 eV).
5. Puisque ces raies sont émises, on peut en déduire deux transitions électroniques de l’atome.
On a En – E1
= ![]() et En =
et En = ![]() E1.
On peut donc calculer, en J, les énergies de deux niveaux électroniques.
E1.
On peut donc calculer, en J, les énergies de deux niveaux électroniques.
Soit Ex = ![]() + (-1.68 10-18) = -1.336 10-18
J soit -8.35 eV
+ (-1.68 10-18) = -1.336 10-18
J soit -8.35 eV
Et Ey
= ![]() + (-1.68 10-18) = -1.337 10-18
J soit -8.36 eV
+ (-1.68 10-18) = -1.337 10-18
J soit -8.36 eV
On obtient donc l’ébauche
suivante :
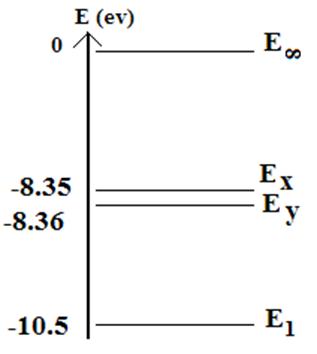
Remarque : Les
niveaux ont été nommés Ex et Ey puisqu’on ne connaît pas
encore les énergies de tous les niveaux.
6. Il
faudrait connaître, avec précision, toutes les longueurs d’ondes des raies du
spectre d’émission du mercure. Certaines raies correspondent à des transitions
vers l’état fondamental et d’autres, en général moins intenses, correspondent à
des transitions vers d’autres niveaux d’énergie. Avec l’ensemble de ces données
on peut reconstruire le diagramme des niveaux d’énergie de l’atome de mercure.